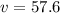 км/ч
км/ч  м/с
м/с 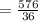 м/с
м/с 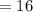 м/с.
м/с.


 м .
м .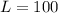 м .
м .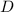 в [м] и [мм].
в [м] и [мм]. и это означает, что каждые
и это означает, что каждые 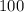 секунд, в положении Н оказывается Начало очередного состава. Уже припаркованный состав простоял на станции
секунд, в положении Н оказывается Начало очередного состава. Уже припаркованный состав простоял на станции 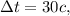 а это означает, что следующему за ним составу осталось проехать из положения С (начало скоростного состава) до точки Н (начало припаркованного состава) в течение
а это означает, что следующему за ним составу осталось проехать из положения С (начало скоростного состава) до точки Н (начало припаркованного состава) в течение 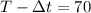 секунд.
секунд.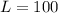 м.
м.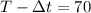 секунд, оставшихся идущему следом составу, первые
секунд, оставшихся идущему следом составу, первые  секунд он будет идти с постоянной скоростью
секунд он будет идти с постоянной скоростью 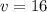 м/с из положения С в положение О, а последующие
м/с из положения С в положение О, а последующие  секунд он будет останавливаться из положения О до положения Н.
секунд он будет останавливаться из положения О до положения Н. м . Теперь найдём СО, т.е. длину
м . Теперь найдём СО, т.е. длину 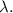 Мы знаем, что по отрезку СО состав двигается равномерно со скоростью
Мы знаем, что по отрезку СО состав двигается равномерно со скоростью  в течение времени
в течение времени  секунд, значит отрезок СО, т.е.
секунд, значит отрезок СО, т.е. 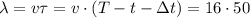 м
м  м .
м . м
м 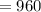 м.
м.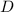 – это длина СК, равная разности СН и КН, т.е. СН и
– это длина СК, равная разности СН и КН, т.е. СН и 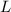 .
.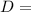 СК
СК  CH
CH 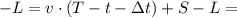
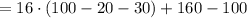 м
м  м.
м.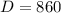 м
м  мм .
мм .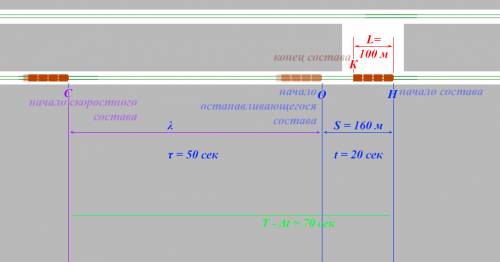
В хозяйственных магазинах продаётся медный купорос, который используют для борьбы с вредителями сельскохозяйственных растений. Если к голубому водному раствору купороса осторожно, по каплям, добавлять нашатырный спирт (водный раствор аммиака NH3), то выпадает голубой осадок гидроксида меди: CuSO4 + NH3 + Н2O = Cu(OH)2v + (NH4)2SO4 (стрелка, направленная вниз, означает выпадение осадка).
Если осадок немного подогреть (предварительно с него лучше осторожно слить раствор), он почернеет: образовался нерастворимый оксид меди.
Такой же оксид можно получить в результате реакции соединения, если внести в пламя конец медной проволоки и раскалить докрасна.
На меди появится чёрный налёт оксида: 2Cu + O2 = 2СuО.
С медным купоросом легко провести реакцию замещения, если опустить в раствор железный гвоздь (предварительно его желательно очистить от грязи мелкой наждачной бумагой).
Довольно быстро гвоздь покрывается красным налётом чистой меди. А если опыт повторить с одним и тем же раствором (или положить в него много мелких железных предметов), голубой раствор постепенно станет светло-зелёным.
Такой цвет имеет сульфат железа FeSO4; кристаллы этого вещества называются железным купоросом. А теперь проведём красивый опыт с той же медной проволокой и раствором аммиака.
В неширокую металлическую банку нальём на донышко немного крепкого нашатырного спирта (не вдыхать!
). Из медной проволоки скрутим плоскую спираль и, держа проволоку за длинный конец, раскалим спираль на газовой горелке и быстро, чтобы она не успела остыть, внесём её в банку, не касаясь стенок и дна. Произойдёт чудо: вместо того чтобы быстро остыть, проволока останется раскалённой!
Особенно хорошо это заметно в тёмном помещении. Объясняется опыт тем, что в банке находится и воздух, и испарившийся из раствора аммиак.
При окислении аммиака кислородом: 4NH3 + 5O2 = 4NO + 6Н2O выделяется очень много энергии. А так как реакция идёт на поверхности медной проволоки, теплота передаётся меди и не даёт ей остыть.
Этот опыт демонстрирует очень важное явление в химии — катализ. Катализатором называется вещество, которое само в реакции не расходуется, но без которого реакция не идёт (или идёт иначе).
В данном случае катализатором была медь, вернее, её поверхность.