- 7 кН
20 кН
-31 кН*м
Объяснение:
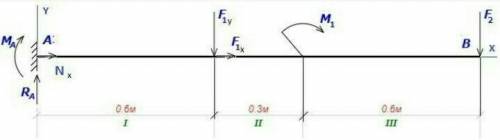
Сделаем чертеж.
Раскладываем силу F₁ на вертикальную и горизонтальную составляющую по теореме Вариньона:
F₁y = F₁*sin 60⁰ = 14*√3 / 2 ≈ 12 кН
F₁ₓ = F₁*cos 60⁰ = 14*1 / 2 ≈ 7 кН
1)
Сумма проекций всех сил на ось OX должна равняться нулю.
∑Fₓ = Nₓ + F₁ₓ = 0
Nₓ = - F₁ₓ = - 7 кН
Знак "-" говорит о том, что реакция заделки направлена противоположно
2)
Сумма проекций всех сил на ось OY должна равняться нулю.
∑Fy = Ra - F₁y - F₂ = 0
Ra = F₁y + F₂ = 12 + 7,8 ≈ 20 кН
3)
Сумма моментов всех сил относительно точки A должна равняться нулю:
∑Ma = - MA - F₁y*AB - F₂*AC - m = 0
- MA - 12*0,6 - 7,8*1,5 - 12 = 0
MA ≈ - 31 кН*м
Знак "-" говорит о том, что момент заделки направлен противоположно указанному на чертеже.
Проверку сделайте самостоятельно: найдите сумму моментов относительно точки В. Она должна быть равна нулю!.
(Подсказка: -12+12*0,9+20*1,5-31 = -2,2 ≈ 0. Несовпадение вызвано погрешностью вычислений).
Спросите кого угодно, что произойдет с температурой идеального газа, который расширяется в замкнутом сосуде без теплообмена с окружающей средой, и почти все вам ответят, что газ охладится. Не «верьте! Это не всегда так.
Вообразим такой мысленный эксперимент. Пусть одна половина теплоизолированного сосуда занята идеальным газом с давлением p1 и температурой T1, а другая — пуста (рис. 1). В некоторый момент уберем перегородку между половинами сосуда. Газ, естественно, будет расширяться, причем в пустоту, и после многочисленных столкновений его молекул со стенками и между собой установится новое равновесное состояние. Ясно, что теперь объем газа вдвое больше: V2 = 2V1. А каковы его давление p2 и температура T2?
Рис. 1
С одной стороны, так как процесс адиабатический, точки, соответствующие начальному и конечному состояниям газа, должны лежать на адиабате 1—2’ (рис. 2). Адиабата, как известно, падает круче изотермы, поэтому температура газа должна уменьшаться: T’2 < T1.
Рис. 2
С другой стороны, посмотрим, что говорит первый закон термодинамики. Количество теплоты Q, подведенное к газу, идет на увеличение его внутренней энергии ΔU и на работу по расширению А:
Q=ΔU+A .
В нашем случае Q = 0 (по условию адиабатичности). А какая работа совершается газом? Да никакой, потому, что он расширяется в вакуум, со стороны которого не встречает противодействия. Значит, и сила, и работа равны нулю: А = 0. Следовательно, и изменение внутренней энергии тоже равно нулю: ΔU = 0. Но поскольку в случае идеального газа внутренняя энергия зависит только от температуры, температура не изменится: T2 = T1, и давление станет равным p2=p12. Это означает, что точки, соответствующие начальному и конечному состояниям, будут лежать на изотерме 1-2.
А что происходит между этими состояниями? К сожалению, школьная термодинамика ничего об этом сказать не может. Почему? Да потому, что вся она верна только для очень медленных (так называемых квазистатических) процессов, которые происходят со скоростями, много меньшими тепловой скорости движения молекул. В нашем же случае как только мы уберем перегородку, газ буквально бросится в вакуум со скоростью порядка тепловой скорости молекул и даже еще быстрее, потому что в газе есть отдельные молекулы, скорость которых намного больше тепловой. А тут термодинамика просто неверна. Вот почему на рисунке 2 мы изобразили неизвестный нам процесс штрихами, а не сплошной линией.
Все наши рассуждения справедливы для случая идеального газа. А если газ не идеальный? Тогда его молекулы взаимодействуют друг с другом, и внутренняя энергия газа складывается из кинетической энергии движения молекул и потенциальной энергии их взаимодействия.
На рисунке 3 изображена зависимость потенциальной энергии П взаимодействия двух молекул от расстояния r между ними. Там, где потенциальная энергия минимальна (точка r0), вещество конденсируется, т. е. переходит в жидкое состояние.
Рис. 3
Так как, по условию, мы имеем в начальный момент газ, то среднее расстояние между молекулами соответствует точке r1 >> r0. После удвоения объема среднее расстояние между молекулами станет равным r2=r12–√3>r1. Получилось, как будто в результате расширения газ слегка «вытащили» наверх, по склону потенциальной ямы. Но кто поработал над тем, чтобы увеличить потенциальную энергию на ΔП? Никто. И сам газ тоже ни над кем не работал. Поэтому остается признать, что увеличение потенциальной энергии произошло за счет уменьшения кинетической энергии движущихся молекул. Значит, и температура — мера средней кинетической энергии молекул газа — в результате расширения слегка упадет. Но это верно только в случае реального газа.