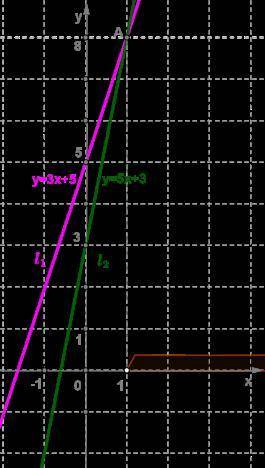
Для решения неравенства 3x+5<5x+3 построим графики линейных функций, расположенных в правой и левой части данного уравнения, т. е. построим графики y=3x+5 и y=5x+3.
Для построения графика каждой линейной функции составим таблицу значений.
Для функции y=3x+5 имеем:
x 0 1
y 5 8
Через полученные точки проведём прямую l1.
Для функции y=5x+3 имеем:
x 0 −1
y 3 −2
Через полученные точки проведём прямую l2.
Прямые y=3x+5 и y=5x+3 пересекаются в точке A(1;8). В этой точке значения функций равны.
Используя построение, делаем вывод: для того чтобы значение первой функции было меньше значения второй функции, необходимо, чтобы первый график был ниже второго, т. е. при x>1.
Можно проверить ответ, полученный при построении, решая неравенство:
3x+5<5x+3;3x−5x<3−5;−2x<−2;x>1.
Объяснение:
ответ: в воду опустили кирпич Cб = 879 Дж/кг *°C.
Объяснение:
mб = 500 г = 0,5 кг.
tб 18 °C.
mв = 400 г = 0,4 кг.
Cв = 4200 Дж/кг *°C.
tв = 100 °C.
t = 83 °C.
Cб - ?
Для определения вещества из которого сделан брусок, необходимо определить удельную теплоёмкость материала из которого сделан брусок Cб.
Qб = Qв.
Qб = Cб *mб *(t - tб).
Qв = Cв *mв *(tв - t).
Cб *mб *(t - tб) = Cв *mв *(tв - t).
Cб = Cв *mв *(tв - t) /mб *(t - tб).
Cб = 4200 Дж/кг *°C *0,4 кг *(100 °C - 83 °C) /0,5 кг *(83 °C - 18 °C) = 879 Дж/кг *°C.
Согласно таблицы удельной теплоёмкости веществ, Cб = 879 Дж/кг *°C соответствует материал кирпич.
ответ: в воду опустили кирпич Cб = 879 Дж/кг *°C.
Cv = iR/2, Cp = Cv + R = (i+2)R/2, где i - число степеней свободы молекулы газа, R-универсальная газовая постоянная (R=8.31 Дж/(К*моль))
И у азота, и кислорода - двухатомные молекулы (N₂ и O₂), число степеней свободы равно 5 (i=5).
Cv = 5R/2, Cp = 7R/2.
Молярная теплоемкость С и удельная теплоемкость с связаны соотношением С=cM, где M - молярная масса газа.
Отсюда с = C/M.
Рассчитаем условную молярную массу смеси 20% кислорода и 80% азота.
M = 0.2*M(O₂) + 0.8*M(N₂) = 0.2*32 + 0.8*28 = 28.8 г/моль
Отсюда
c(v) = Cv/M = (5R/2)/M = 5R / (2M) =
= 5*8.31 Дж/(К*моль) / (2*28,8 г/моль) = 0,72 Дж/(К*г).
с(p) = Cp/M = 7R/(2M) = 7*8.31 Дж/(К*моль) / (2*28,8 г/моль) =
= 1.01 Дж/(К*г).
ответ:с(v) = 0,72 Дж/(К*г), c(p) = 1,01 Дж/(К*г)
Примечание. Поскольку состав газовой смеси близок к воздуху, интересно сравнить полученные результаты соответствующими теплоемкостями воздуха. По справочным данным для воздуха с(p) = 1.00 Дж/(К*г), c(v) = 0,717 Дж/(г·К).
Как видно, довольно близко к значениям, полученным в решении.