В результате взаимодействия фосфата калия с нитратом серебра (K3PO4 + AgNO3 = ?) происходит образование осадка белого цвета фосфата серебра (I) и нитрата калия. Молекулярное уравнение реакции имеет вид:
\[ K_3PO_4 + 3AgNO_3 \rightarrow Ag_3PO_4_solid + 3KNO_3.\]
Запишем ионные уравнения, учитывая, что фосфат серебра (I) на ионы не распадается, т.е. не диссоциирует.
\[ 3K^{+} + PO_4^{3-} + 3Ag^{+} + 3NO_3^{-} \rightarrow Ag_3PO_4 + 3K^{+} + 3NO_3^{-};\]
\[ PO_4^{3-} + 3Ag^{+} \rightarrow Ag_3PO_4.\]
Объяснение:
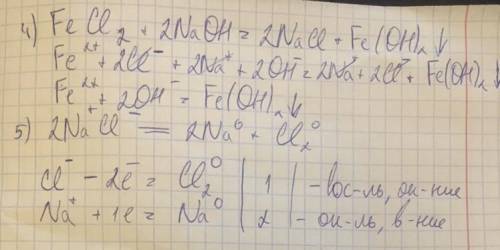
5.1. Теоретическая часть
Электрохимические процессы, как и окислительно-восстановительные реакции (ОВР), связаны с изменением степени окисления веществ, участвующих в реакции. Основное отличие ОВР от электрохимических процессов заключается в том, что процессы восстановления и окисления пространственно разделены и перенос электронов может быть зафиксирован как некоторый ток (в гальваническом элементе, при коррозии) или, наоборот, электрохимический процесс может происходить за счет внешнего источника тока (электролиз).
В любом случае для протекания электрохимической реакции необходима электрохимическая цепь, существенными компонентами которой являются электроды и электролит (водный или неводный).