6 г х моль
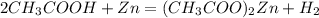
120 г 1 моль
1. Знайдемо чисту массу етанової кислоти у розчині:
m(CH3COOH)=m(розчину)*w(CH3COOH)=50*0,12=6 г
2. Підставивши цю масу у рівняння,розрахуємо кількість речовини водню:
при взаємодії 120 г кислоти виділяється 1 моль водню, а
при -- // -- 6 г____________________х г, звідки
х=6*1/120=0,05 моль
3. А тепер з формули по визначенню кількості речовини, знайдемо:
а) m(H2)=M(H2)*v(H2)=2*0,05=0,1 г
б) V(H2)=Vm(H2)*v(H2)=22,4*0,05=1,12 л
Уравнение реакции:
CaCl2+Na2CO3=CaCO3+2NaCl
Так как указано количество только соды, считаем что хлорид кальция находится в избытке или стехиометрическом соотношении и расчет количества продукта реакции рассчитываем по соде.
Атомный вес натрия Na=23
Атомный вес углерода С=12
Атомный вес кислорода О=16
Атомный вес кальция Ca=40
Молярный вес кальцинированной соды Na2CO3=23*2+12+16*3=106
Молярный вес карбоната кальция CaCO3=40+12+16*3=100
Мы взяли 200 граммов 5,3% раствора соды. Проценты - это количество вещества в 100 граммах смеси.
Таким образом мы взяли 200*5,3/100=10,6 граммов чистой 100% соды.
Теперь составляем пропорцию с учетом стехиометрических коэффициентов:
106 - 100
10,6 - Х
Х=10,6*100/106=10 граммов соды.
ответ: в результате данной реакции мы получим 10 граммов карбоната кальция.
Подробнее - на -
Объяснение: