І.Выберите три верных ответа. С водородом реагируют оба вещества в наборах: 1,3,5
ІІ.1.Сначала определим массу соли в первоначальном растворе:
m1(соли)=m1(раствора)*w1(соли)=100*0,15=15 г
2.Узнаем массу соли в новом растворе,сложив уже имеющуюся(ту,что только что определили) и добавленную:
m(соли)=m1(соли)+m2(соли)=15+50=65 г
3.Вычислим массу нового раствора,сложив массу первоначального раствора с массой добавленной соли:
m2(раствора)=m1(раствора)+m2(соли)=100+50=150 г
4. Отнеся массу соли в новом растворе к массе этого раствора,получим массовую долю соли в новом растворе:
w2(соли)=m(соли)/m2(раствора)=65/150=0,43 или 43%
ІІІ.
+7 -1 +2 0
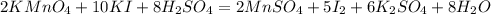
+7 +2
Mn + 5e = Mn|2| окислитель(восстановление)
-1 0
2I - 2e = I2 |5| восстановитель(окисление)
IV.
4488 г х л
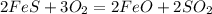
176 г 44,8 л
1. Определим чистую массу сульфида в образце:
5610 г образца - это 100%,
у г_______________80%, откуда у=5610*80/100=4488 г
2. По этой массе,подставив ее в уравнение реакции,определим объем сернистого газа:
при взаимодействии 176 г сульфида образуется 44,8 л сернистого газа, а
при --//--//-- 4488 г__________________Х л, откуда=
х=4488*44,8/176=1142 л или 1,142 м в кубе
1) В. Fe₂O₃ – оксид железа (III);
Г. SO₂ - оксид серы (IV).
2) Б. Al(NO₃)₃ - нитрат алюминия;
Г. ZnBr₂ - бромид цинка;
Е. Mg(OH)₂ - гидроксид магния.
3) 1. CaCl₂ - А. 111
2. Al₂O₃ - В. 102
3. Zn(OH)₂ - Г. 99
4. SnO - Б. 135
4) - Г. 3
5) - А. NH₄Cl, Na₃PO₄, K₂CO₃
6) - А. N₂
7) - Б. проявляет основные свойства
8) Выбрать вещество, где фосфор проявляет (наибольшую) наименьшую степень окисления:
А. P³⁻H₃⁺ – (3-);
Б. P⁵⁺₂O₅²⁻ – (5+);
В. H₃⁺P⁵⁺O₄²⁻ – (5+);
Г. Ca²⁺₃(P⁵⁺O²⁻₄)₂ – (5+).
ответ: А. PH₃.
9) - Б. графит.
Практическая часть
1. Расставьте коэффициенты в следующих уравнениях реакций и укажите тип каждой реакции:
1) Ba²⁺O²⁻+2H⁺Cl⁻→Ba²⁺Cl⁻₂+H⁺₂O²⁻ - реакция обмена;
2) Mg⁰+H⁺₂SO₄²⁻→Mg²⁺SO₄²⁻+H₂⁰↑ - реакция замещения;
3) 2H⁺₂O²⁻→O₂⁰+2H₂⁰ - реакция разложения;
4) 2H⁺Cl⁻+Ca²⁺(OH)⁻₂→Ca²⁺Cl⁻₂+2H⁺₂O²⁻ - реакция обмена.
2. Составьте уравнения химических реакций согласно схеме:
1) 2Na⁰+2H⁺₂O²⁻→2Na⁺OH⁻+H₂⁰↑;
2) 2Na⁺OH⁻+Cu²⁺SO₄²⁻→ Cu²⁺(OH)⁻₂↓+Na⁺₂SO₄²⁻;
3) 2Cu²⁺(OH)⁻₂↓→2Cu²⁺O²⁻+2H⁺₂O²⁻;
4) Cu²⁺O²⁻+H₂⁰→ Cu⁰+H⁺₂O²⁻.
Объяснение:
Mr(H2CO3)=1×2+12+16×3=72 г/моль
Mr(CO2)=12+16×2=44 г/моль
Mr(SO2)=32+16×2=64 г/моль
Mr(P2O5)=31×2+16×5=142 г/моль
Mr(K2SO3)=39×2+32+16×3=158 г/моль
Mr(MgCl2)=24+35,5×2=95 г/моль
Mr(Na2S)=23×2+32=78 г/моль
Mr(CaC2)=40+12×2=64 г/моль