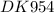Окисление альдегида оксидом серебра: «реакция серебряного зеркала» - в чистую пробирку налейте 2 мл раствора нитрата серебра и к нему добавляйте по каплям разбавленный раствор аммиака до растворения осадка. к полученному раствору добавьте несколько капель раствора этаналя. пробирку поместите в стакан с горячей водой.
- что происходит в пробирке? напишите уравнение протекающей реакции.
2. окисление альдегидов гидроксидом меди (формула гидроксида меди? ) – получите осадок гидроксида меди. к осадку прилейте раствор альдегида и несколько капель щелочи, встряхните и нагрейте содержимое. наблюдайте, как сначала появляется желтый осадок гидроксида меди (формула полученного который при дальнейшем нагревании превращается в красный оксид меди (формула оксида меди? )
- что образуется при окислении альдегидов? напишите уравнения соответствующих реакций.
дополнительное :
3. осуществить цепочку превращений.
сн4---с2н2---с2н4---сн3сон---с2н5он---с2н5cl---c2h4---co2
4. дать определение понятиям альдегиды и кетоны.
напишите общий вывод к работе
Дано:
m(р-ра NaOH) = 50 гр
ω(NaOH) = 10%
Найти:
m(C₁₇H₃₅-COONa) - ?
1) Для начала мы напишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться. Уравнение этой реакций представлен внизу↓.
2) Далее находим массу чистого вещества у гидроксида натрия, а потом его количества вещества, и потом количества вещества у образовавшейся соли по уравнению реакций:
m(NaOH) = (m(р-ра NaOH)×ω(NaOH))/100% = (50 гр × 10%)/100% = 50 гр × 0,1 = 5 гр
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 5 гр / 40 гр/моль = 0,125 моль
n(NaOH) : n(C₁₇H₃₅-COONa) = 3 : 3 = 1 : 1 ⇒ n(C₁₇H₃₅-COONa) = n(NaOH) = 0,125 моль - по уравнению реакций
3) Теперь находим массу образовавшейся соли:
M(C₁₇H₃₅-COONa) = 12×18 + 1×35 + 16×2 + 23 = 216 + 35 + 32 + 23 = 306 гр/моль
m(C₁₇H₃₅-COONa) = n(C₁₇H₃₅-COONa)×M(C₁₇H₃₅-COONa) = 0,125 моль × 306 гр/моль = 38,25 гр
ответ: m(C₁₇H₃₅-COONa) = 38,25 гр
Решено от :