не списывай оттуда, там ошибка
вот правильное:
HClO3 - окислитель
Mg - восстановитель
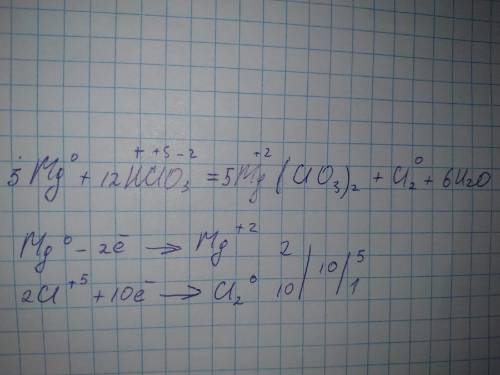
Объяснение:
Задача 1
Дано:
m(р-р H₂SO₄) = 30 гр
ω%(H₂SO₄) = 20%
ω%(выход) = 90%
Найти:
m(соли) - ?
9 гр x - гр
Fe(OH)₃ + 3H₂SO₄ → Fe(SO₄)₃ + 6H₂O
3 моля 1 моль
294 гр/моль 344 гр/моль
ω%(H₂SO₄) = m(H₂SO₄)×100% / m(р-р H₂SO₄)
30% = m(H₂SO₄)×100% / 30 гр
m(H₂SO₄) = 30%×30гр / 100% = 900/100 = 9 гр
M(H₂SO₄) = 3×(1×2+32+16×4) = 3×(2+32+64) = 3×98 = 294 гр/моль
M( Fe(SO₄)₃ ) = 56+(32+16×4)×3 = 56+(32+64)×3 = 56+96×3 = 56+288 = 344 гр/моль
x( Fe(SO₄)₃ ) = m(H₂SO₄)×M( Fe(SO₄)₃ ) / M(H₂SO₄)
x = 9 гр × 344 гр/моль / 294 гр/моль = 3096 моль / 294 гр/моль = 10,53 гр
ω%(выход) = m(соли)×100% / m( Fe(SO₄)₃ )
90% = m(соли)×100% / 10,53 гр
m(соли) = 10,53 гр×90% / 100% = 947,7 / 100 = 9,477 ≈ 9,48 гр
ответ: m(соли) = 9,48 гр
Задача 2
Дано:
m(Na₂CO₃) = 90 гр
V(прак) = 15,2 л
Найти:
φ%(вых) - ?
90 гр х - л
Na₂CO₃ + H₂SO₄ → Na₂SO₄ + H₂O + CO₂↑
1 моль 1 моль
106 гр/моль 22,4 л/моль
M(Na₂CO₃) = 23×2+12+16×3 = 46+12+48 = 46+60 = 106 гр/моль
Vm(CO₂) = 22,4 л/моль
x(CO₂) = m(Na₂CO₃)×Vm(CO₂) / M(Na₂CO₃)
x = 90 гр × 22,4 л/моль / 106 гр/моль = 2016/106 = 19,02 л ≈ 19 л
φ%(вых.) = V(прак)/V(теор) × 100%
φ%(вых.) = 15,2 л / 19 л × 100% = 0,8 × 100% = 80%
ответ: φ%(вых.) = 80%
Объяснение:
1. Хром соединениях проявляет различной степени окисления . Заполнить таблицу :
Степень Оксид Гидроксид Характер Форма растворах
окисления
+2 CrO Cr(OH)₂ основной соли голубые
+3 Cr₂O₃ Cr(OH)₃ амфотерный соли зеленые
+4 CrO₂ нет несолеобразующий
+6 CrO₃ H₂CrO₄ кислотный хроматы желтые
H₂Cr₂O₇ бихроматы оранжевые
2.Допишите уравнение реакции
и расставьте коэффициенты Используя метод электронного баланса
а) Cr⁺³Cl₃ + NaOH+Br₂⁰ → Na₂Cr⁺⁶O₄ + NaBr⁻ + NaCl + H₂O
Cr⁺³-3e = Cr⁺⁶ 3 2
6
2Br⁰+2×e⁻ = 2Br⁻ 2 3
Cr⁺³восстановитель, процесс окисления
Br⁰ окислитель, процесс восстановления
2CrCl₃ + 16NaOH + 3Br₂ = 2Na₂CrO₄ + 6NaBr + 6NaCl + 8H₂O
б) K₂Cr⁺⁶O₄ + Fe⁺²SO₄ + H₂SO₄→ Fe₂⁺³(SO₄)₃ + Cr₂⁺³(SO₄)₃+K₂SO₄ + H₂O
Но в кислой среде (H₂SO₄) хромат переходит в бихромат :
K₂Cr₂⁶⁺O₇ + Fe⁺²SO₄ + H₂SO₄ → Fe₂⁺³(SO₄)₃ + Cr₂⁺³(SO₄)₃ + K₂SO₄ + H₂O
Cr⁺⁶+3e⁻ = Cr⁺³ 3 1
3
Fe⁺²-e⁻=Fe⁺³ 1 3
Cr⁺⁶окислитель, процесс восстановления
Fe⁺²восстановитель, процесс окисления
K₂Cr₂O₇+6FeSO₄+7H₂SO₄=3Fe₂(SO₄)₃+Cr₂(SO₄)₃ + K₂SO₄ +7H₂O
в) K₂Cr₂⁺⁶O₇ + HCI⁻¹ →Cl₂⁰ + Cr⁺³Cl₃ + KCl + H₂O
Cr⁺⁶+3e⁻ → Cr⁺³ 3 2
6
2CI⁻¹-2×e⁻ →Cl₂⁰ 2 3
Cr⁺⁶окислитель, процесс восстановления
CI⁻восстановитель, процесс окисления
K₂Cr₂O₇ + 14HCI = 3Cl₂ + 2CrCl₃ + 2KCl + 7H₂O
3. Напишите уравнения реакций с которых можно осуществить следующие превращения:
CrCl₃→ Na₂CrO₄→ Na₂Cr₂O₇→ Cr₂(SO₄)₃→Cr(OH₃)→Na₃[Cr(OH)₆]
2CrCl₃+3NaClO+10NaOH=2Na₂CrO₄+9NaCl+5H₂O
2Na₂CrO₄+2HCI=Na₂Cr₂O₇+2NaCI+H₂O
Na₂Cr₂O₇+4H₂SO₄+6HI= 3I₂ +Cr₂(SO₄)₃+Na₂SO₄+7H₂O
Cr₂(SO₄)₃+6NaOH=2Cr(OH)₃+3Na₂SO₄
Cr(OH)₃+3NaOH=Na₃[Cr(OH)₆]
4.Оксид Cr₂O₃ можно перевести в растворимое состояние
a) с нитратом натрия в присутствии гидроксида натрия с карбонатом натрия:
Cr₂O₃+3KNO₃+2Na₂CO₃=Na₂CrO₄+3KNO₂+2CO₂
б) на воздухе: Cr₂O₃+6HCI=2CrCI₃+3H₂O
5. Известно что хромистый железняк
FeOCr2O3 ( FeCr2O4) является наиболее распространённым минералам. Предложите уравнение реакции отражающие процесс его растворении в концентрированной азотной кислоте.
FeCr₂O₄ + 10HNO₃ = 2Cr(NO₃)₃ + Fe(NO₃)₃ + NO₂ + 5H₂O
Объяснение:
не забудь поставить 5 звезд