100 г 45 л,х л у г
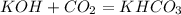
56 г 22,4 л 100 г
1. Рассчитаем чистую массу гидроксида в растворе:
m(KOH)=m(раствора)*w(KOH)=400*0,25=100 г
2. Подставив в уравнение эту массу,определим,какое их исходных веществ прореагирует полностью,приняв,например объем углекислого газа за Х:
для полного взаимодействия 56 г гидроксида необходимо 22,4 л углекислого газа, а
для -- // -- 100 г_____________________х л, откуда
х=100*22,4/56=40 л
3. Так как углекислого газа имеем больше,чем необходимо на самом деле,то значит расчет массы соли ведем по массе гидроксида:
при взаимодействии 56 г гидроксида образуется 100 г соли, а
при -- // -- 100 г____________________у г, откуда
у=100*100/56=179 г
2Mg+O₂-->2MgO
Сначала найдём количество магния по формуле n=m/M, где n-колличество вещества, m-масса, M-молярная масса:
n(Mg)=12г:24г/моль=0,5моль
Теперь смотрим на коэффициенты перед магнием и кислородом.
Перед магнием стоит 2, а перед кислородом 1.
Значит, колличество кислорода в 2 раза меньше колличества магния:
n(O₂)=n(Mg)/2=0,5моль:2=0,25моль
Теперь можем найти объём кислорода по формуле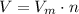
где V-объём,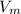 -молярный объём (у газов он всегда равен 22,4 л/моль), n-колличество вещества:
-молярный объём (у газов он всегда равен 22,4 л/моль), n-колличество вещества:
V(O₂)=22,4л/моль·0,25моль=5,6л
ответ: 5,6 л.