2. Какие элементы имеют следующие электронные конфигурации?
a) 1s22s22p63s23p64s23d104p65s24d105p66s25d14f4 → Nd
b) 1s22s22p4 → O
c) 1s22s22p63s23p64s23d7 → Co
d) 1s22s22p63s23p64s23d104p65s24d105p6 → Xe
3. Сколько орбиталей имеет каждый из следующих подуровней?
а) s → 1 b) d → 5 с) f → 7 d) p → 3
4. Сколько электронов имеет каждый из следующих подуровней?
а) s → 1 или 2 b) d → до 10 с) f → до 14 d) p → до 6
5. Сколько электронов может размещаться на каждом из следующих энергетических уровней?
a) 1 → 2 b) 6 → 72 c) 3 → 18 d) 4 → 32
Если мы возьмем бериллия Be поглощает одну α-частицу, то получится что один нейтрон, который становится изотопом другого элемента, а какой именно сейчас найдем:
1) Сначала запишем уравнение ядерной реакция с бериллием и одну α-частицу:
⁹₄Be + ⁴₂He → ᵃₙX + ¹₀n
2) Далее запишем систему уравнение про А(а)-массовое число, и Z(n)- протонное число этого элемента:
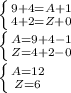
3) Мы получаем что А(а)-массовое число равно 12, и Z(n)- протонное число равное 6, следовательно мы смотрим на таблицу элементов, мы получаем что изотопом этого элемента - это углерод (С), следовательно мы запишем уравнение ядерной реакции:
⁹₄Be + ⁴₂He → ¹²₆C + ¹₀n
ответ: изотопом другого элемента - это ¹²₆C
131,15 мл.
Объяснение:
Реакция нейтрализации щавелевой кислоты идёт согласно уравнению:
HOOC - COOH + 2NaOH = NaOOC - COONa + 2H2O
На 1 моль щавелевой кислоты (90 граммов) расходуется 2 моль (80 граммов) гидроксида натрия. Тогда на нейтрализацию 36 граммов кислоты понадобится 36*80/90 = 32 грамма NaOH, что содержится в 32*100:20 = 160 граммах 20%-ного раствора, объём которого равен 160:1,22 = 131,15 мл.