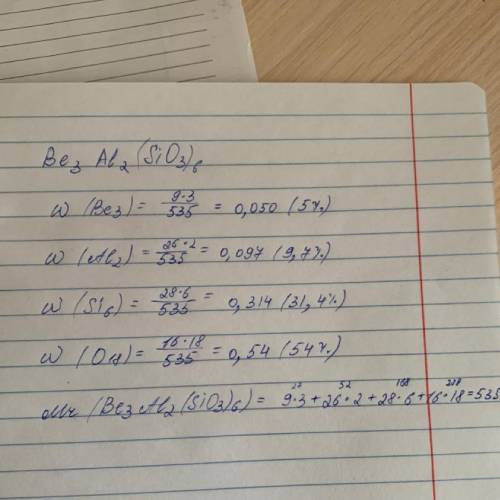
Объяснение:
Запишем общую формулу изумруда:
Be₃Al₂(SiO₃)₆
Общая молярная масса: 9*3 + 27*2 + (28 + 16*3)*6 = 27 + 54 + 456 = 537
Найдем массовую долю бериллия:
w(Be) = M(Be) / M(Be₃Al₂(SiO₃)₆) = 27 / 537 = 0,05 = 5%
Найдем массовую долю алюминия:
w(Al) = M(Al) / M(Be₃Al₂(SiO₃)₆) = 54 / 537 = 0,1 = 10%
Найдем массовую долю кремния:
w(Si) = M(Si) / M(Be₃Al₂(SiO₃)₆) = 168 / 537 = 0,312 = 31,2%
Найдем массовую долю кислорода:
w(O) = M(O) / M(Be₃Al₂(SiO₃)₆) = 288 / 537 = 0,536 = 53,6%
если не использовать реактивы, то соединения можно распознать по внешним физическим свойствам, а именно по цвету
[Cu(NH3)4]SO4 - Сульфат тетраамминмеди(II) — растворяется в воде, образует кристаллогидраты — синие кристаллы.
Na3[Сr(OH)6] - Гексагидроксохромат(III) натрия — зелёное аморфное вещество.
Fe2(SO4)3 - сульфат железа(III) светло-жёлтые кристаллы. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
CuSO4 - Сульфат меди(II) в безводном виде — белый порошок, очень гигроскопичное. Из водных растворов кристаллизуется голубой пентагидрат (медный купоро́с) CuSO4·5H2O.
K2Cr2O7 - Дихрома́т ка́лия имеет вид оранжевых кристаллов.
K2CrO4 - Хромат калия жёлтые кристаллы.
NaCl - Хлорид натрия с бесцветными кристаллами
KMnO4 - Перманганат калия тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии.
Объяснение:
Решить задачу: Какое количество теплоты выделится при сгорании 11.2 л ацетилена , если тепловой эффект реакции равен 2610 кдж.
Запишем термохимическое уравнение горения ацетилена.
11,2 л
С2Н2 + О2 = 2СО2 + Н2О + 2610 кДж
Согласно термохимическому уравнению при сгорании 1 моль ацетилена выделяется 2610 кДж теплоты.
11,2 л ацетилена соответствуют 0,5 моль Отсюда составим пропорцию;
1 моль 2610 кДж х = 1305 кДж
0,5 моль х кДж