1. Разб. H2SO4 будет взаимодействовать с Fe, CaO, CaCl2, NaOH.
Ps насчёт оксида брома (7), не скажу точно, но его даже не синтезировали.
Fe+H2SO4(разб)=FeSO4+H2
Fe(0) -2e=Fe(+2) окисление, восстановитель.
2H(+1)+2e=H2(0) восстановление, окислитель.
CaO+H2SO4(разб)=CaSO4+H2O
Не ОВР.
CaCl2+H2SO4(разб)=CaSO4+2HCl
Не ОВР.
2NaOH+H2SO4(разб)=Na2SO4+2H2O
Не ОВР.
2. а) Ca(NO3)2=Ca(No2)2+O2
N(+5)+2e=N(+3) восстановление, окислитель.
O(-2)-2e=O(0) окисление, восстановитель.
ОВР такое же в б) и в).
б) Fe(NO3)2=Fe(No2)2+O2
в) Hg(No3)2=Hg(No2)2+O2. HgNo2, при дальнейшем нагреве образует металл.
3. C+O2=CO2 уголь восстановитель.
C+2S=CS2 уголь восстановитель.
4. 1)P+3Li=Li3P.
2) Li3P+3H2O=PH3+3LiOH
3)(Нельзя из фосфина получить оксид, сначало нужно получить обычный фосфор, потом его сжечь).
3) 2PH3=(t разложение) 2P+3H2
4) 4P+5O2=2P2O5
5) P2O5+3CaO=Ca3(Po4)2
6) Ca3(Po4)2+3H2=3Ca+2H3PO4
5. 4P+5O2=2P2O5
n(P)=m/M= 0.4
n(p)=n(o)
m(o)=n*M=0.4*16=6.4
v(o)=n*Vm=0.4*22.4=8.96
х г 33,6 л
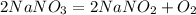
170 г 22,4 л
1. Сначала найдем массу чистой селитры,из которой собственно был получен кислород данным объемом:
при взаимодействии 170 г селитры выделится 22,4 л кислорода,а
при -- // -- х г___________________33,6 л, откуда
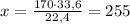 г
г
2.Отняв от образца селитры чистую ее массу(которую только что рассчитали),получим массу примесей:340-255=85 г
3. Отнеся эту массу к массе всего образца и будет массовая доля примесей:
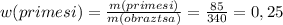 або 25%
або 25%
Объяснение:
1) H2SO4 - серная кислота
HCl - соляная кислота
2)2 Fe(OH)3 -> Fe2O3 + 3H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
3) 2Ca + O2 = 2CaO
CaO + 2HCl = CaCl2 + H2O
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl
4) 2Na + 2H2O = 2NaOH + H2
Fe(NO3)2 + K2S = FeS + 2KNO3
N2O5 + 2NaOH = 2NaNO3 + H2O
5) Cu(NO3)2 + Na2CO3 = CuCO3 + 2NaNO3
6) MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Mg(OH)2 -> MgO + H2O
7) H2SO4 + Fe = FeSO4 + H2
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
H2SO4 + BaSO3 = BaSO4 + SO2 + H2O