9.12 г
Объяснение:
m( раствора HCl) = 75г
w(HCl) = 30% = 0.3
выход(MgCl2) = 32% = 0.32
Найти: m(MgCl2) - ?
Уравнение реакции: Mg + 2HCl = MgCl2 + H2
m(HCl) = m(раствора HCl) * w(HCl) = 75г * 0.3 = 22.5 г
n(HCl) = m(HCl) : M(HCl) = 22.5г : 36.5 г/моль = 0.6 моль
2 моль HCl 1 моль MgCl2
0.6 моль HCl x моль MgCl2
n(MgCl2) = x = 0.6 моль / 2 = 0.3 моль (теоретическое количество)
n(MgCl2)практ. = n(MgCl2)теор. * выход
n(MgCl2) = 0.3 моль * 0.32 = 0.096 моль (практическое количество)
m(MgCl2) = n(MgCl2) * M(MgCl2) = 0.096 моль * 95 г/моль = 9.12 г
ответ: 9.12 г
1.
А. 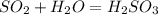
Б. 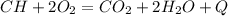
В. 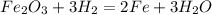
1.
А. 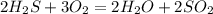
Б. 
В. 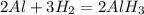
2.
mH2O = 35г
mсоли = 10г
mраствора = mсоли+mводы = 35г+10г = 45г
w = mсоли/mр-ра = 10г/45г*100% = 22,2%
2.
mр-ра = 300г
wсоли = 0,05
mсоли = w*mр-ра = 0,05*300г = 15г
mводы = mр-ра - mсоли = 300-15 = 285г
3.
C -> XH4 -> CO2 -> H2CO3
1. C + 2H2 = CH4 - соединение, обр. метан
2. CH4 + 2O2 = CO2 + 2H2O - разложение, с образованием углекислого газа и воды.
3. CO2 + H2O = H2CO3 - соединение, обр. уголная кислота
3.
Al -> Al2O3 -> Al -> Al(OH)3
1. 4Al + 3O2 = 2Al2O3 - соединение, обр. оксид алюминия.
2. 2Al2O3 --эл. ток--> 4Al + 3O2 - разложение, обр. алюминий и кислород
3. 2Al + 6H2O = 2Al(OH)3 + 3H2 - замещение, обр. гидроксид алюминия и водород.
Н° 298(реакц)=88 кДж
Объяснение:
Тепловой эффект данной реакции находится по следствию из закона Гесса:
Н° 298(реакц)=Н° 298 (Н2О)+Н° 298 (СО2)+Н° 298 (Na2СО3)-2*Н° 298 (NaНСО3)
Н° 298(реакц)=(-285)+(-393,5)+(-1135,3) -2*(-951,3)=88 кДж