1. CO2 - сложное вещество, с ковалентной полярной связью, состоит из двух элементов - углерод со степенью окисления +4 и кислорода со степенью окисления -2, валентность углерода (IV), кислорода (II);
2. Название элемента, символ, порядковый номер, относительную атомную массу, в некоторых таблицах предоставлен внешний энергетический слой и электронная конфигурация;
3. H2 - водород, Br2 - бром, U - уран;
4. Cl2O7 - оксид хлора (VII), C6H5-C6H5 - дифенил, B2H6 - диборан;
5. Любое определенное химически чистое соединение, независимо от его получения, состоит из одних и тех же химических элементов, причём отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами;
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ. При химических реакциях атомы не исчезают и не появляются. Продукты реакции образуются из атомов, содержащихся в исходных веществах. Поэтому масса и остаётся неизменной;
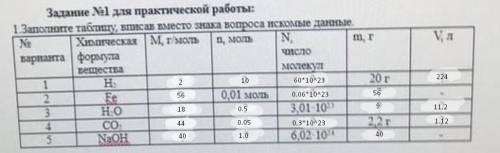
Согласно закону Авогадро, одно и то же количество молекул любого газа занимает при одинаковых условиях один и тот же объём. С другой стороны, 1 моль любого вещества содержит, по определению, одинаковое количество частиц, например, молекул. Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
Объяснение:
Думаю, вывод Вы сами напишите)
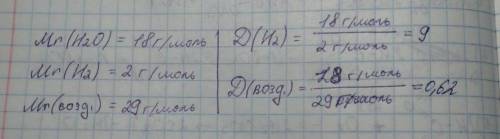
усть у Вас есть 100 г (именно масса, 100 г, а не 100 мл, хотя в данной ситуации погрешность невелика)9 %-ного уксуса. Это значит, что в этих 100 г содержится 9 г уксусной кислоты.В 6 %-ном уксусе эти же 9 г составляют 6 %, Значит масса 6 %-ного раствора равна 9/0,06=150 г (опять же г, а не мл). В общем случае, при разбавлении растворов нужно пользоваться такой формулой: m1*c1=m2*c2, откуда m2=m1*(c1/c2), где m1,m2 массы, а с1 и с2 - концентрации (массовые концентрации, массовые проценты, или массовые доли) исходного и разбавленного растворов соответственно.
Я постоянно подчеркивал, что при разбавлении фигурируют именно массы, а не объемы растворов. Если же вводить объемы (v1 и v2) и плотности ро1 и ро2 растворов, то формула разбавления будет такой: v1*ро1*c1=v2*ро2*c2, откуда v2=v1*(ро1/ро2)*(с1/с2). Поскольку плотности 9 и 6 %-ных растворов уксусной кислоты (ро1 и ро2) различаются незначительно, то в данной ситуации с достаточной для практики точностью можно принять, что они одинаковы, и их соотношение равно 1. Тогда формула упрощается: v2=v1*(с1/с2). Значит из 1 литра 9 %-ного уксуса нужно сделать 1,5 л разбавленного уксуса, и он будет 6 %-ным.
Еще раз подчеркну, если для разбавления 9 %-ного уксуса до 6 %-ного эта упрощенная формула (по объемам) годится, то для разбавления 70-80 %-ной "уксусной эссенции" до концентраций 6-9 %, или для разбавления серной кислоты (при приготовлении электролита для аккумулятора) уже не годится, слишком велики погрешности. Ну а формула через массы m2=m1*(c1/c2)- годится ВСЕГДА, в любой ситуации.
Объяснение:
1)бутан
2)2,3метилбутан
3)3,4метил,4етил гептан
4)3,5етил октан