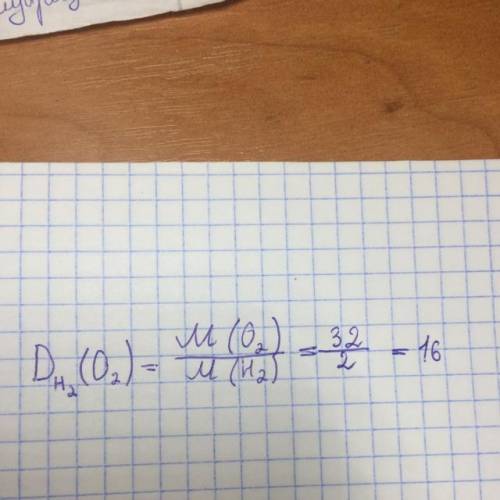
Объяснение:
Mr(H₂SO₄)=2Ar(H)+Ar(S)+4Ar(O) (записуємо відносну атомну масу елементів і вказуємо попереду елемента індекси).
Mr(H₂SO₄)=2+32+4x16=2+32+65=98 (знаходимо в ПСХЕ атомні маси, множимо на індекс і визначаємо молекулярну масу ).
Визначаємо масові частки елементів, для цього ділимо відносну масу елемента на молекулярну масу:
ω(H)=2Ar(H)÷Mr(H₂SO₄)=2÷98=0,0204
ω%(H)=ω(H)×100%=0,0204×100%=2,04
ω(S)=Ar(S)÷Mr(H₂SO₄)=32÷98=0,3265
ω%(S)=ω(S)×100%=0,3235×100%=32,65%
ω(O)=4Ar(O)÷Mr(H₂SO₄)=64÷98=0,6531
ω%(O)=ω(O)×100%=0,6531×100%=65,31%