Самостоятельная работа «Металлы и их соединения»
Часть А.
Выбрать один правильный ответ
А1. Электронная формула атома алюминия:
1)1s22s22р1 2) 1s22s2 2p63s2 3) 1s22s2 2p63s23р1
4) 1s22s2 2p63s23p3
А2. В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
А3. Металл, обладающий самой высокой пластичностью, - это:
1) золото 2) медь 3) серебро 4) алюминий
А4. Не взаимодействует с раствором серной кислоты
1) цинк 2) серебро 3) никель 4) железо
А5. Оксид алюминия взаимодействует с каждым из двух веществ:
1) HCl и O2 2) КOH и H2О 3) HCl и KOH 4) NaNO3 и H2SO4
А6. В качестве восстановителя при выплавке чугуна в доменных печах используют:
1) водород 2) алюминий 3) кокс 4) магний
Часть В.
В1.Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe + Cl2 1) Fe2(SO4)3 + H2O
Б) Fe + HCl 2) FeSO4 + H2O
В) Fe2O3 + H2SO4 3) FeCl3
Fe + CuSO4 4) FeCl2 + H2
5) FeSO4 + Cu
6) Fe2(SO4)3 + Cu
Часть С.
С1. Напишите уравнения реакций, с которых можно осуществить следующие превращения:
Ca →Ca(OH)2 → CaCO3 →Ca(HCO3)2 → CaCl2 →Ca(NO3)2.
Переход 1 рассмотрите в свете ОВР; переходы 4 и 5 - с позиции электролитической диссоциации.
C2. Рассчитайте массу железа, которое можно получить из 144 г оксида железа(II) в реакции с алюминием.
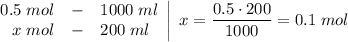
вар.1) 17г 22,2г хг
2AgNO3 + CaCl2 = 2AgCl + Ca(NO3)2
v=2моль v=1моль v=2моль
М=170г/моль М=111г/моль М=143,5г/моль
m=340г m=111г m=287г
найдем избыток и недостаток
17/340 < 22,2/111
AgNO3-недостаток,расчет ведем по недостатку
v(AgNO3)=17г/(170г/моль)=0,1моль
v(AgNO3)=v(AgCl)=0,1моль
m(AgCl)=M*v=143,5г/моль*0,1моль=14,35г
ответ:14,35г хлорида серебра
вар2.) 26,1г 4,5г хг
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
v=1моль v=1моль v=1моль
М=261г/моль М=98г/моль М=233г/моль
m=261г m=98г m=233г
26,1/261 >4,5/98
H2SO4-недостаток
v(H2SO4)=4,5г/(98г/моль)=0,046моль
v(BasO4)=v(H2SO4)=0,046моль
m(BaSO4)=0,046моль*233г/моль=10,7г
ответ:10,7г сульфата бария
вар3) 50г 20г хг
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
v=1моль v=2моль v=1моль
М=160г/моль М=40г/моль М=142г/моль
m=160г m=80г m=142г
50/160 > 20/80
NaOH-недостаток
v(NaOH)=20г/(40г/моль)=0,5моль
v(Na2SO4)=v(NaOH):2=0,5моль:2=0,25моль
m(Na2SO4)=0,25моль*142г/моль=35,5г
ответ:35,5 г сульфата натрия