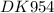одноатомные спирты6
1) с активными металлами:
2СН3ОН+2Na--->2CH3ONa+H2^
2) с (кислотами) гидрогалогенирование:
CH3OH+HCl--->CH3CL+H2O
3)Дегидратация:
а) Межмолекулярная:условия ( t <140) CH3OH+CH3OH--->CH3-O-CH3
б) Внутримолекулярная: условия( t>140) C2H5OH--->H2C=Ch2+H2O
4) Горят: 2Ch3OH+O2--->2CO2^ +4H2O
5) Реакции окисления: С2H5OH+CuO--> Ch3-COOH+ H2O+Cu
6) реакции этирификации: спирт + карбиновые кислоты.
P.s. только уравнения реакции не на примере гексанола-1 ( там если, что подставишь, соорентируешься)
Дано:
n(CH₃-COOH) = 0,26 моль
m(CH₃-COOK) = 9,8 гр
Найти:
m(Ca(OH)₂) - ?
m(KOH) - ?
1) Для начала мы запишем уравнений реакций при нейтрализаций смеси, именно по таким уравнениям мы будем пользоваться:
Ca(OH)₂ + 2CH₃-COOH → (CH₃-COO)₂Ca + 2H₂OKOH + CH₃-COOH → CH₃-COOK + H₂O2) Далее находим количества вещества у ацетата калия, а потом у гидроксида калия:
M(CH₃-COOK) = 12 + 1×3 + 12 + 16 + 16 + 39 = 12 + 3 + 83 = 98 гр/моль
n(CH₃-COOK) = m(CH₃-COOK)/M(CH₃-COOK) = 9,8 гр / 98 гр/моль = 0,1 моль ⇒ n(KOH) = n(CH₃-COOH) = 0,1 моль
3) Теперь находим массу гидроксида калия:
M(KOH) = 39 + 16 + 1 = 56 гр/моль
m(KOH) = n(KOH) × M(KOH) = 0,1 моль × 56 гр/моль = 5,6 гр
4) Теперь находим количества вещества уксусной кислоты, которое образовалось из реакций при добавление KOH:
n₂(CH₃-COOH) = n(CH₃-COOK) = 0,1 моль
5) Далее находим количества оставшейся уксусной кислоты образовавшееся в 1-ой реакций при добавлений Ca(OH)₂ :
n₁(CH₃-COOH) = n(CH₃-COOH) - n₂(CH₃-COOH) = 0,26 моль - 0,1 моль = 0,16 моль
6) Теперь находим количества вещества у гидроксида кальция из 1-ой уравнений реакций:
n(Ca(OH)₂) = 1/2 × n₁(CH₃-COOH) = 1/2 × 0,16 моль = 0,08 моль
7) Теперь находим массу гидроксида кальция:
M(Ca(OH)₂) = 40 + (16 + 1)×2 = 40 + 17×2 = 40 + 34 = 74 гр/моль
m(Ca(OH)₂) = n(Ca(OH)₂) × M(Ca(OH)₂) = 0,08 моль × 74 гр/моль = 5,92 гр
ответ: m(Ca(OH)₂) = 5,92 гр m(KOH) = 5,6 гр
Решено от :