3С + 4HNO3 = 3CO2 + 4NO + 2H2O
C(0) - 4e = C(+4) востановитель 3
N(+5) + 3e = N(+2) окислитель 4
4HCl + O2 = 2H2O + 4Cl2
O2 +4e = 2O(-2) окислитель 1
2Cl(-1) - 2e = Cl2 восстановитель 2
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Cu(0) -2e =Cu(+2) востановитель 3
N(+5) + 3e = N(+2) окислитель 2
2H2S + 3O2 = 2SO2 + 2H2O
O2 +4e = 2O(-2) окислитель 3
S(-2) -6e = S(+4) востановитель 2
4NH3 + 5O2 = 4NO +6H2O
N(-3) -5e = N(+2) востановитель 4
O2 +4e = 2O(-2) окислитель 5
2Н2SO4+Cu=CuSO4+SO2+2H2O
Cu(0) -2e =Cu(+2) востановитель 1
S(+6) + 2e = S(+4) окислитель 1
P2O5 + 5C = 2P + 5CO
2P(+5) +10e = 2P окислитель 1
C(0) - 2e = C(+2) востановитель 5
3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO + 4H2O
Zn(0) - 2e =Zn(2+) востановитель 3
N(+5) + 3 e =N(+2) окислитель 2
2H2SO4+ C = 2SO2 + CO2 + 2H2O
S(+6) + 2e = S +4 окислитель 2
C(0) - 4e = C +4 востановитель 1
вар.1) 17г 22,2г хг
2AgNO3 + CaCl2 = 2AgCl + Ca(NO3)2
v=2моль v=1моль v=2моль
М=170г/моль М=111г/моль М=143,5г/моль
m=340г m=111г m=287г
найдем избыток и недостаток
17/340 < 22,2/111
AgNO3-недостаток,расчет ведем по недостатку
v(AgNO3)=17г/(170г/моль)=0,1моль
v(AgNO3)=v(AgCl)=0,1моль
m(AgCl)=M*v=143,5г/моль*0,1моль=14,35г
ответ:14,35г хлорида серебра
вар2.) 26,1г 4,5г хг
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
v=1моль v=1моль v=1моль
М=261г/моль М=98г/моль М=233г/моль
m=261г m=98г m=233г
26,1/261 >4,5/98
H2SO4-недостаток
v(H2SO4)=4,5г/(98г/моль)=0,046моль
v(BasO4)=v(H2SO4)=0,046моль
m(BaSO4)=0,046моль*233г/моль=10,7г
ответ:10,7г сульфата бария
вар3) 50г 20г хг
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
v=1моль v=2моль v=1моль
М=160г/моль М=40г/моль М=142г/моль
m=160г m=80г m=142г
50/160 > 20/80
NaOH-недостаток
v(NaOH)=20г/(40г/моль)=0,5моль
v(Na2SO4)=v(NaOH):2=0,5моль:2=0,25моль
m(Na2SO4)=0,25моль*142г/моль=35,5г
ответ:35,5 г сульфата натрия
1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
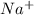

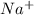
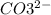

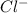
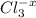


3С + 4HNO3 = 3CO2 + 4NO + 2H2O
C(0) - 4e = C(+4) востановитель 3
N(+5) + 3e = N(+2) окислитель 4
4HCl + O2 = 2H2O + 4Cl2
O2 +4e = 2O(-2) окислитель 1
2Cl(-1) - 2e = Cl2 восстановитель 2
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Cu(0) -2e =Cu(+2) востановитель 3
N(+5) + 3e = N(+2) окислитель 2
2H2S + 3O2 = 2SO2 + 2H2O
O2 +4e = 2O(-2) окислитель 3
S(-2) -6e = S(+4) востановитель 2
4NH3 + 5O2 = 4NO +6H2O
N(-3) -5e = N(+2) востановитель 4
O2 +4e = 2O(-2) окислитель 5
2Н2SO4+Cu=CuSO4+SO2+2H2O
Cu(0) -2e =Cu(+2) востановитель 1
S(+6) + 2e = S(+4) окислитель 1
P2O5 + 5C = 2P + 5CO
2P(+5) +10e = 2P окислитель 1
C(0) - 2e = C(+2) востановитель 5
3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO + 4H2O
Zn(0) - 2e =Zn(2+) востановитель 3
N(+5) + 3 e =N(+2) окислитель 2
2H2SO4+ C = 2SO2 + CO2 + 2H2O
S(+6) + 2e = S(+4) окислитель 2
C(0) - 4e = C(+4) востановитель 1
Объяснение: