В результате прямой перегонки нефти получено и час 33800 кг бензиновой фракции
(93-123°С), массовые доли компонентов в которой равны: парафины 7,4%,
непредельные 0,5%, ароматические 0,7%, нафтены 71,4%. Определить компонентный
состав фракции и массовый расход нефти, если выход фракции составляет 48% от
общей массы нефти, поступающей на установку прямой перегонки.
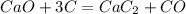
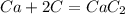
Литий (химический символ - Li; лат. Lithium) - элемент первой группы
Объяснение:
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите K2Li3Al5[Si6O20](F,OH)4. Металлический литий впервые получил Гемфри Дэви в 1818 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решётка относится к группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине[5].
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине (к тому же плотность лития столь мала, что он будет в нём плавать); он может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом и другими газами, находящимися в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3.
{\displaystyle {\ce {6Li + N2 -> 2Li3N}}}{\displaystyle {\ce {6Li + N2 -> 2Li3N}}}
{\displaystyle {\ce {2Li + 2H2O -> 2LiOH + H2}}}{\displaystyle {\ce {2Li + 2H2O -> 2LiOH + H2}}}
Поэтому длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках.
В кислороде при нагревании горит, превращаясь в оксид Li2O.
{\displaystyle {\ce {4Li + O2 -> 2Li2O}}}{\displaystyle {\ce {4Li + O2 -> 2Li2O}}}
Интересная особенность лития в том, что в интервале температур от 100 °C до 300 °C он покрывается плотной оксидной плёнкой и в дальнейшем не окисляется. В отличие от остальных щелочных металлов, дающих стабильные надпероксиды и озониды; надпероксид и озонид лития — нестабильные соединения[6].
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура самовоспламенения находится в районе 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2.