Вычисли массу кислорода, который содержится в порции фосфорной кислоты массой 240 г. В промежуточных расчётах результат округляй до сотых, ответ — до целых.
Уравнение реакции( один из вариантов): Чтобы расчитать выход продукта, нам нужно узнать сколько теоретически должно было выделиться продукта( "на бумаге"). Воспользуемся известной массой уксусного альдегида и найдём, сколько этого самого альдегида вступило в реакцию: n( количество вещества) = m( масса) / M( молярная масса) - общая формула = 4,4 / 44= 0,1 моль Из уравнения реакции видно, что коэффициент перед уксусным альдегидом равен коэффициенту перед уксусной кислотой, т.е. = = 0,1 моль Теперь, пользуясь уже знакомой формулой n( количество вещества) = m( масса) / M( молярная масса), мы можем найти массу ( теоретическую) уксусной кислоты: = = 0,1 * 60 = 6 г. Выход продукта расчитываем по формуле: w = m( практ) / m( теор) * 100% = 90% ответ: выход продукта составил 90%.
1) При окислении алканола CuO обр-ся альдегид, кот-й взаимод-т с Ag2O с обр-м металл-го Ag (M = 108 г/моль) по р-ии: R-CHO + Ag2O (NH3*H2O) = R-COOH + 2Ag, n R-CHO = 0.5*n Ag = 0.5*(43.2/108) = 0.2 моль, а молярная масса R-CHO сос-т 11.6/0.2 = 58 г/моль, что с учетом ф-лы R-CHO, указывает на пропаналь H3C-CH2-CHO: M R = 58-29 = 29 г/моль, 12*n+2*n+1 = 29, n = 2 (R = C2H5);
2) т.о. с учетом 1) исх-м алканолом явл-ся пропанол-1 H3C-CH2-CH2OH, вступивший в р-ию C3H7OH (M = 60 г/моль) + CuO = H3C-CH2-CHO + Cu + H2O; его масса сос-т соот-но 60*((11.6*2)/58) = 24 г.
Уравнение реакции( один из вариантов):
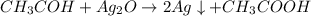
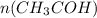 = 4,4 / 44= 0,1 моль
= 4,4 / 44= 0,1 моль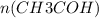 =
= 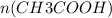 = 0,1 моль
= 0,1 моль
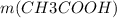 =
= 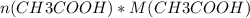 = 0,1 * 60 = 6 г.
= 0,1 * 60 = 6 г.
Чтобы расчитать выход продукта, нам нужно узнать сколько теоретически должно было выделиться продукта( "на бумаге").
Воспользуемся известной массой уксусного альдегида и найдём, сколько этого самого альдегида вступило в реакцию:
n( количество вещества) = m( масса) / M( молярная масса) - общая формула
Из уравнения реакции видно, что коэффициент перед уксусным альдегидом равен коэффициенту перед уксусной кислотой, т.е.
Теперь, пользуясь уже знакомой формулой n( количество вещества) = m( масса) / M( молярная масса), мы можем найти массу ( теоретическую) уксусной кислоты:
Выход продукта расчитываем по формуле:
w = m( практ) / m( теор) * 100% = 90%
ответ: выход продукта составил 90%.