FeBr₃
Объяснение:
Валентность атома соединяться с другими атомами. Т.е. непосредственно валентность определяется через число связи.
Сразу можно выбросить Fe(OH)₃, хоть в этом соединении железо и проявляется валентность III, но оно относится к классу оснований, а не солей.
Есть две соли: FeBr₃ и FeSO₄. Железо образует 3 связи в сумме со всеми атомами брома, а с сульфат-ионом лишь 2 (или одну двойную).
Плюс иногда, но не всегда, валентность совпадает со степенью окисления. В FeBr₃ у железа степень окисления +3 → валентность III, а в FeSO₄ - +2 → валентность II (НО ЭТО НЕ ВСЕГДА)
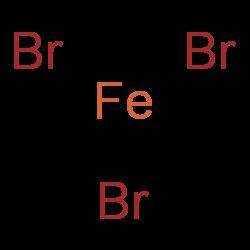
S2+2H2=2H2S
2S+4H=4H(+)+2S(-2)
ОВР :
Восстановление:S + 2e− = S2− 1
Окисление:H − 1e− = H+ 2
S + 2H = S2− + 2H+
O3 + H2S(газ) = SO2 + H2O
3O+2H(+)+S(-2)=S(+4)+2O(-2)
Восстановление:O3 + 6H+ + 6e− = 3H2O 6 6 1
Окисление: S2− + 2H2O − 6e− = SO2 + 4H+ 6 1
O3 + 2H+ + S2− = H2O + SO2
2SO2+O2=2SO3
2S(+4)+4O(-2)+2O=2S(+6)+6О(-2)
Восстановление: O + 2e− = O2− 2 2 1
Окисление: S4+ − 2e− = S6+ 2 1
O + S4+ = O2− + S6+
SO3 + H2O(хол.) = H2SO4(разб.)
S(+6)+3O(-2)+H2O=2H(+)+ SO4(-2)
CuO + H2SO4 = CuSO4 + H2O
Cu(+2)+O(-2)+2H(+)+SO4(02)=Cu(+2)+SO4(-2)
CuSO4+BaCl2=CuCl2+BaSO4(осадок)
Cu(+2)+SO4(-2)+Ba(+2)+2Cl(-)=Cu(+2)+2Cl(-)+BaSO4
Мова
Завантажити PDF
ігати
Редагувати
Інертні гази — це гази, які є зазвичай хімічно інертними (нереактивними) і в умовах заданої хімічної реакції не беруть участі в її перебігу. Зазвичай до інертних газів належать азот, вуглекислий газ, благородні гази, гексафторид сірки та ін. Інертні гази відзначаються великим значенням негативної ентальпії утворення. Вони є без запаху та неядовиті. Благородні гази також часто не реагують з багатьма речовинами і історично їх називали інертними газами. Проте у ширшому розумінні є також і інші інертні гази, які зазвичай використовуються для уникнення небажаних хімічних реакцій, що погіршують зразок. На відміну від благородних газів, інертний газ не обов'язково є елементарним і часто є газом, сполукою із декількох елементів. Багато хімічних реакцій вимагають їх проведення в атмосфері інертного газу через те, що кисень та водяна пара, що містяться у повітрі, можуть перешкоджати і утворювати небажані побічні продукти. Використання конкретного інертного газу пристосовується для конкретних умов. Наприклад азот, як інертний газ може бути використаний при паянні, а при використанні зварювання металів при високій температурі він може вступати у небажану реакцію, тому його заміняють на дещо дорожчий аргон, який як благородний газ і при високій температурі є інертним. Інертні гази застосовують для прополоскування місць у посудинах, де можуть нагромаджуватися залишки горючих газів, для їх видалення, у випадку коли кисень повітря може утворювати з цими рештками горючі суміші. При витіснені кисню із атмосфери, що оточує певні процеси, наприклад плавки металів, інертні гази запобігають горінню, вибухам
прости что долго
тут заковырка "формулу СОЛИ" так что FeSO4