50 г 120г,х г у г
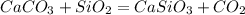
100 г 60 г 116 г
1. Сначала определим,какое из исходных веществ прореагировало полностью(без остатка),приняв,например,массу оксида кремния за Х:
для полного взаимодействия 100 г карбоната необходимо 60 г оксида кремния, а
для -- // -- 50 г_____________________х г, откуда
х=50*60/100=30 г
2. Так как для полного взаимодействия 50 г карбоната необходимо всего 30 г,а взято 120,то значит оксид кремния останется в излишке,поэтому расчет теоретически возможной массы силиката ведем по массе карбоната:
при взаимодействии 100 г карбоната образуется 116 г силиката, а
при -- // -- 50 г_____________________у г, откуда
у=50*116/100=58 г
3. Отношение практически полученной массы массы вещества к теоретически возможной и есть выходом продукта:
выход продукта=m факт./m теор.=45/58=0,78 или 78%
12,6 г х г
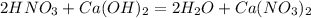
126 г 164 г
1. Найдем чистую массу азотной кислоты в растворе:
m(HNO3)=m(раствора)*w(HNO3)=200*0,063=12,6 г
2. Подставив эту массу в уравнение реакции,определим теоретически возможную массу нитрата кальция:
при взаимодействии 126 г кислоты образуется 164 г соли, а
при -- // -- 12,6 г__________________х г, откуда
х=12,6*164/126=16,4 г
3. Отношение фактической массы к теоретически возможной и будет выходом продукта:
выход продукта=m факт./m теор.=15/16,4=0,91 или 91%
Объяснение:
C2H5Br+NaOHC2H5OH
C2H5OH---t° CH3CHO+0.5H2
CH3CHO+[O]CH3COOH
CH3COOH+CH3OH---CH3COOCH3+H2
CH3COOCH3+H2CH3OH+C2H5OH
2CH3OH+O2CO2+H2O