16.9%
Объяснение:
Пишем первую реакцию
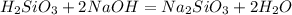
Считаем массу гидроксида натрия
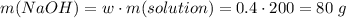
Считаем количество вещества кремниевой кислоты
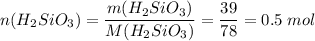
Для реакции нужно вдвое больше гидроксида натрия, т.е. 1 моль или 40 г, а есть 80 г, поэтому расчеты ведем по кремниевой кислоте
Силиката натрия образуется столько же, сколько и было кремниевой кислоты, т.е. 0.5 моль
Пишем вторую реакцию
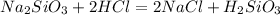
Для полного взаимодействия с 0.5 моль силиката натрия нужно 1 моль кислоты, т.е. 36.5 г. Считаем сколько есть
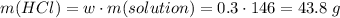
Видим, что соляной кислоты в избытке, поэтому расчеты ведем по силикату натрию
Во время реакции образуется 1 моль хлорида натрия, т.е. 58.5 г и 0.5 моль кремниевой кислоты, т.е. 39 г, которая выпадает в осадок и в массе раствора не считается
Считаем всю массу раствора
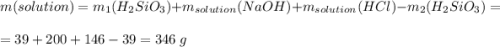
Считаем массовую долю хлорида натрия

1. Реакция ионного обмена. Очевидно, что в результате выделиться сульфат бария (это и есть осадок, от которого отделили раствор) и хлорид меди.
2. На электродах происходит электролиз хлорида меди. На катоде будет восстанавливаться медь.
3. При реакции меди с концентрированной серной кислотой будет образовываться сульфат меди, диоксид серы (он же и есть тот самый газ в условии) и вода.
4. Здесь протекает реакция окислительно-восстановительная.
Сульфат калия здесь получился потому, что в результате реакции на самом деле будет оксид серы (VI), но так, как наша среда щелочная (а щелочь, увы, там ни с чем, кроме получившегося оксида, не будет реагировать), там будет образовываться сульфат калия.