1. 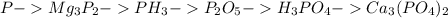
1) 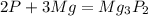
2) 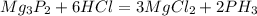
3) 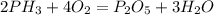
4) 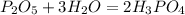
5) 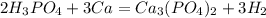
2. 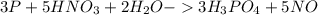
окисление 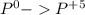 (-5e) восстановитель |5|3
(-5e) восстановитель |5|3
восстановление 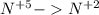 (+3e) окислитель |3|5
(+3e) окислитель |3|5
3. Дано:
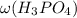 =80%
=80%
m(P)=31кг
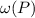 =5%
=5%
________________________________
m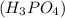 =?
=?
0,2 x
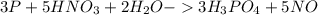
3кмоль 3кмоль
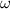 чист.(P)=100%-80%=20%
чист.(P)=100%-80%=20%
mчист.(P)=31кг*0,2=6,2кг
n(P)=6,2кг/31кг/кмоль=0,2кмоль
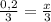 x=n(
x=n(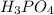 )=0,2кмоль
)=0,2кмоль
m(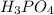 )=0,2кмоль*98кг/кмоль=19,6кг
)=0,2кмоль*98кг/кмоль=19,6кг
m(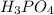 )=19,6кг*08=15,68 кг
)=19,6кг*08=15,68 кг
ответ: 15,68кг
1) +14 Si )₂)₈)₄
1s²2s²2p⁶3s²3p²
+7 N )₂)₅
1s²2s²2p³
2) B - 1
S - 2
Cl - 1
Ar - 0
3) Количество нейтронов/протонов в ядре:
¹²С - 6 нейтронов , 6 протонов
¹³С - 7 нейтронов, 6 протонов
4) Радиус атома цезия намного больше радиуса атома лития, поэтому в атоме лития сила притяжения больше
5) Элемент 4-го периода, 7-й группы - Mn имеет электронную конфигурацию 1s²2s²2p⁶3s²3p⁶4s²3d⁵. Максимальная степень окисления +7