ответ следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. Можно привести строение атомов углерода С, азота N, кислорода О, фтора F. Это позволит сделать вывод о том, что по мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.
Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей. Приведем примеры.
Можно добавить, что некоторые неметаллы могут реагировать и со сложными веществами (оксидами, кислотами, солями). Следующие уравнения учащийся приводит по желанию:
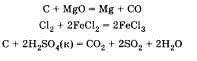
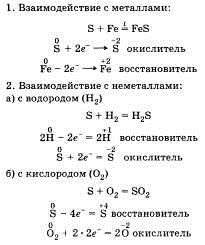

Формалин это раствор формальдегида.
1)Узнаем сколько у нас вообще участвовало вещества формалина в реакции.Формула такая:w=m(в-ва)*100%/m (р-ра)
A)
Выводим: m(в-ва)=w*m(р-ра)/100%
Подставляем: m(в-ва)=40% * 600г/100%= 240 г.
Это масса формалина,который участвовал в реакции.
2)Напишем уравнение реакции:
240г х г
HCHO + Ag2O> HCOOH + 2Ag(над стрелкой NH4OH)
M=30г/моль 108г/моль
m =30г 216г
Составляем пропорцию 240/30=x/216
Следовательно : x=240*216/30 = 1 728г
ответ:1 728 г или примерно 1,7 кг.
B)
2Na+2C6H5OH= 2C6H5ONa + H2
m (Na) 5-0.125=4.875
n(Na) = 4.875/23= 0.2
n (H2)= 0.1 (по уравнение реакции)
V (H2) =22.4*0.1= 2.24 л
С)
прости не знаю
D)
тоже прости
E)
CH3-CH2-OH + HBr(изб.) -> CH3-CH2-Br + H2O
n(C2H5OH) = 92/46 = 2 моль
n(C2H5Br) = 2*0.85 = 1.7 моль
m(C2H5Br) = 1.7*109 = 185.3 г,
F)
CH3-COOH + Cl2 (P красный) -> Cl-CH2-COOH + HCl
n(CH3COOH) = 120/60 = 2 моль
теоретически n(Cl-CH2-COOH) = n(CH3-COOH) = 2 моль
реально n(Cl-CH2-COOH) = 170/94.5 = 1.799 моль
[выход продукта] = 1.799/2 = 0.8995 <=> 89.95 %
G)
m(CH3-C=O-H = 90
m(C2H5OH)=82
CH3-C=O-H + H2 = CH3-CH2-OH
как решить
За ранее благодарна)
М(альдегида)=44 г/моль
М(спирта)=46г/моль, составляем пропорцию:
44г/моль-->46г/моль
90 г --> X г спирта
Х=(90*46):44=94 г.Это 100% выход; 82 г--Х%; Х=(82*100):94=87,2%