1. Если 1000 мл воды содержит 200 мг гидрокарбоната, то
250 мл________________х мг, откуда х=250*200/1000=50 мг или 0,05 г
0,05 г х г
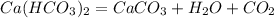
162 г 100 г
При разложении 162 г гидрокарбоната выпадает 100 г карбоната, а
при -- // -- 0,05 г_______________________у г, откуда
у=0,05*100/162=0,03 г или 30 мг
2. Примем массу гидроксида за Х, подставим в формулу по определению массовой доли растворенного вещества и получим уравнение:
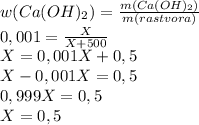 г
г
Теперь,подставив в уравнение массу гидроксида,определим массу оксида:
у г 0,5 г
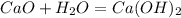
56 г 74 г
при взаимодействии 56 г оксида образуется 74 г гидроксида, а
при -- // -- у г_________________0,5 г, откуда
у=56*0,5/74=0,38 г
2SO2 + O2 = 2SO3(оксид серы 6)
SO3 + H2O(вода) = H2SO4 (серная кислота)
SO2(оксид серы 4) + H2O(вода) = H2SO3(сернистая кислота)
S(сера) + H2(водород) =(t)= H2S(сероводород)
CuCl2(хлорид меди 2) + H2S(сероводород) = CuS↓(сульфид меди 2) + 2HCl (хлороводород)
2CuS + 3O2 = 2CuO(оксид меди 2) + 2SO2( оксид серы 4)
2 вар
4P(фосфор) + 5O2(кислород) = 2P2O5(оксид фосфора 5)
P2O5 + 3H2O(вода) = 2H3PO4(ортофосфорная кислота)
3NaOH(гидроксид натрия) + H3PO4 = Na3PO4(фосфат натрия) + 3H2O
2P(фосфор) + 3HCl(хлороводород) = 2PH3 (фтористый водород) + PCl3(хлорид фосфора 3)
PH3 + O2 = P2O5(оксид фосфора 5) + H2O(вода)
P2O5 + 3Na2O(оксид натрия) = 2Na3PO4(фосфат натрия)
2Na3PO4(фосфат натрия) + 3CaCl2 (хлорид кальция)= Ca3(PO4)2(фосфат кальция) + 6NaCl(хлорид натрия)
Ca3(PO4)2 + 6HCl (хлороводородная кислота)= 3CaCl2 (хлорид кальция)+ 2H3PO4(ортофосфорная кислота)
CaCl2 + 2NaOH(гидроксид натрия0 = Ca(OH)2(гидроксид кальция) + 2NaCl