2)Заряд атома хлора = его порядковому номеру =17
Электронная формула:
Сl +17 .. ) .. ) .. )
2 .. 8 .. 7
1s2 2s2 2p6 3s2 3p5, неспаренный 1 электрон
Типичные соединения:HCl, Cl2O7,NaCl
4) 2KВr + Сl2 = 2KСl + Вr2
Br(-1) -1e = Br2(0) восстановитель
Cl2(0) +1e=Cl(-1) окислитель
то есть перед Br2 и Cl2 ничего не стоит, остальное расставляем так
6) замещения: Cl2 + 2HBr → 2HCl + Br2
соединения: 2Al + 3F2 = 2AlF3
8) 2Na + 2HCl = 2NaCl + H2
MgO + 2HCl = MaCl2 + 2H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
20м3
9) H2 + Cl2 = 2HCl
1моль 1 моль 2 моль
HCl в 2 раза больше, чем H2 и Cl2, значит и объёма в 2 раза больше. Получается 10м3 H2 и 10м3 Cl2
Массовая доля соли в получившемся растворе составляет 19,76%
Объяснение:
Дано:
m (CaC₂) = 12,8 г
V (р-ра HBr) = 174 мл
w (HBr) = 20 %
ρ (р-ра HBr) = 1,12 г/мл
Найти:
w (р-ра CaBr₂)
CaC₂ + 2HBr = CaBr₂ + C₂H₂↑
1) Найдем массу и количество вещества HBr в растворе:
m(р-ра HBr) = V(HBr) ∙ ρ (р-ра HBr) = 174 мл ∙ 1,12 г/мл = 194,88 г
m(HBr) = m(р-ра) ∙ w(р-ра) \ 100%
m(HBr) = 194,88 г ∙ 0,2 = 38,98 г
Молярная масса M(HBr) = 1 + 80 = 81 г/моль
Количество вещества найдем по формуле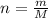
2) Найдем количество вещества карбида кальция:
Молярная масса M(CaC₂) = 40 + 2*12 = 64 г/моль
Количество вещества
3) Соотношение реагирующих веществ:
По уравнению реакции карбид кальция реагирует с бромистоводородной кислотой в отношении 1 моль : 2 моль. Вещества даны в отношении 0,2 моль CaC₂ к 0,48 моль HBr. ⇒ Бромистоводородная кислота дана в избытке. Расчет задачи ведем по недостатку, т.е. по карбиду кальция.
По уравнению реакции из 1 моль CaC₂ образуется 1 моль бромида кальция, значит из 0,2 моль CaC₂ образуется 0,2 моль соли CaBr₂.
Найдем массу образовавшейся соли CaBr₂:
M(CaBr₂) = 40 + 2*80 = 200 г/моль
m(CaBr₂) = n*M = 0,2 моль * 200 г/моль = 40 г.
4) Найдем массовую долю соли CaBr₂ в растворе:
Рассчитаем массу выделившегося из раствора ацетилена. По уравнению реакции из 1 моль CaС₂ образуется 1 моль C₂H₂, а из 0,2 моль CaС₂ образуется 0,2 моль C₂H₂.
M(C₂H₂) = 2 * 12 + 2 = 26 г/моль
m(C₂H₂) = n*M = 0,2 моль * 26 г/моль = 5,2 г.
Масса раствора m(р-ра) = m(CaС₂) + m (HBr) - m(C₂H₂) = 12,8 г + 194,88 г - 5,2 г = 202,48 г.
Массовая доля соли в полученном растворе:
w(CaBr₂) = (m(соли) ∙ 100%) / m(р-ра) = (40 г ∙ 100%) / 202,48 г = 19,76%
ответ: массовая доля соли в получившемся растворе составляет 19,76%.