Привет
Начнем с конца.
CuSO4+ 2NaOH = Cu(OH)2 + Na2SO4
m(р-ра) = 48 г
w(р-ра) = 10%
m(CuSO4) = 48×0.1= 4.8 грамм
n(CuSO4) = 4.8/160= 0.03 моль
Так как CuSO4 и NaOH находятся в молярном соотношении 1 к 2, то следует:
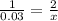
x= 0.06 моль NaOH
При электролизе раствора NaOH выделяется 3 моль газов (2H2 и O2) , но по задаче даётся 134.4 литра
Газы выделяются потому что электролизуется Вода
NaOH не электролизуется
2H2O =(электролиз) 2H2 + O2
При электролизе 2 моль воды, выделятся и улетучивается 3 моль газов, но по задаче даётся 134.4 литра, а это 134.4/22.4 = 6 моль газов
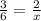
x= 4 моль воды электролизовалось
120×0.1= 12 грамм NaOH
120-12= 108 грамм воды
Так как 72 грамм воды электролизовалось (4×18=72), масса раствора оказалась: 120-72 = 48 грамм
В растворе содержится 12 грамм NaOH
Моль NaOH = 12/40 = 0.3 моль
На осаждение CuSO4 использовали 0.06 моль NaOH
m(NaOH) = 0.06 × 40= 2.4 грамм
Вопрос задачи: Вычислите какую часть (%) раствора использовались для осаждения CuSO4
Масса раствора была 48 грамм - это 100%, 2.4 грамм - X
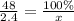
x= 5%
ответ: 5%
Если будут вопросы, отпишитесь в комментариях
1)S + O2 = SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
H2SO4 + K2O = K2SO4 + H2O
K2SO4 + Ba(OH)2 = BaSO4 + 2KOH
2)1)3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O
Cl(0) +2e --> 2Cl(-1) о-к , в-я
Cl(0) -10e --> 2Cl(+5) в-к , о-я
2)MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Mn(+4) +2e --> Mn(+2) о-к , в-я
2Cl(-) -2e --> Cl2(0) в-к , о-я
Объяснение: