Дано:
m(C₁₂H₂₂O₁₁) = 342 гр
Найти:
N(AТФ) - ?
1) Сахароза – дисахарид и состоит из α-D-глюкозы и β-D-фруктозы, их энергетическая ценность при окислении одинакова.
C₁₂H₂₂O₁₁ + H₂O (H⁺ , t°C)→ C₆H₁₂O₆ + C₆H₁₂O₆
Сахароза α-D-глюкоза β-D-фруктоза
2) Для начала мы найдем молекулярную массу сахарозы, а потом находим количества молекул у сахарозы а потом у глюкозы:
M(C₁₂H₂₂O₁₁) = 12×12 + 1×22 + 16×11 = 144 + 22 + 176 = 342 гр/моль
n(C₁₂H₂₂O₁₁) = m(C₁₂H₂₂O₁₁)/M(C₁₂H₂₂O₁₁) = 342 гр / 342 гр/моль = 1 моль ⇒ n(C₆H₁₂O₆) = n(C₁₂H₂₂O₁₁) = 1 моль
3) Теперь находим количества вещества у сахарозы:
N(C₁₂H₂₂O₁₁) = n(C₁₂H₂₂O₁₁)×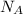 = 1 моль × 6,02×10²³ (моль)⁻¹ = 6,02×10²³ молекул
= 1 моль × 6,02×10²³ (моль)⁻¹ = 6,02×10²³ молекул
4) Теперь найдем сколько молекул АТФ образовалось в результате анаэробного и аэробного условия, зная что в результате анаэробного условия образуется 3 молекулы АТФ, а в результате аэробного условия 38 молекул (в расчёте на 1 молекулу глюкозы):
N(АТФ) = n(АТФ)×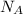 = 3 моль × 6,02×10²³ (моль)⁻¹ = 18,06×10²³ молекул - при анаэробном условий.
= 3 моль × 6,02×10²³ (моль)⁻¹ = 18,06×10²³ молекул - при анаэробном условий.
N(АТФ) = n(АТФ)×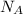 = 38 моль × 6,02×10²³ (моль)⁻¹ = 228,76×10²³ молекул - при аэробном условий.
= 38 моль × 6,02×10²³ (моль)⁻¹ = 228,76×10²³ молекул - при аэробном условий.
ответ: N(АТФ) = 18,06×10²³ молекул - при анаэробном условий.
N(АТФ) = 228,76×10²³ молекул - при аэробном условий.
Решено от : 
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
2) Считаем, сколько чистого гидроксида кальция вступит в реакцию, для этого составляем пропорцию:
500 г - 100%
Х г - 20%
Х = 500*20/100=100 г
3) В уравнении над гидрокисдом кальция пишем 100 г, под гидроксидом кальция записываем его молекулярную массу 40+(16+1)*2 = 74 г
4) Над аммиаком пишем Х л , т.к. по условию ножно найти объем, поэтому будем считать в литрах. Под амииаком пишем 2*22,4л (молярный объем газа) = 44,8 л
5) Составляем пропорцию:
100 г - Х л
74 г - 44,8 л
Отсюда Х=44,8*100/74=60,54 (л)
ответ: 60,54 л