1) В главных подгруппах в основном те металлы, которые имеют постоянную степень окисления(s и p элементы) , у остальных уже появляется d и f уровни, из-за которых наблюдаются переменные степени окисления
2) Потому что у них появляются проскоки электронов, d или f подуровень
3) Потому что они имеют высшую степень окисления и повышать им некуда. Следовательно, они могут быть окислителями(понижать степень окисления)
4) Окисление это принятие электронов( понижение степени окисления)
Восстановление - отдача электронов(повышение степени окисления)
5) Качественными называются те реакции, в которых можно увидеть какие-либо опознавательные признаки соединения в реакции(газ, осадок изменение окраса раствора и тд)
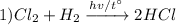
Реакция взаимодействия газообразных хлора и водорода на свету или при нагревании, с получением хлороводорода, реакция соединения
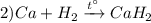
Реакция взаимодействия металлического кальция с парами водорода при нагревании, с образованием гидрида кальция, реакция соединения
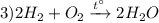
Реакция взаимодействия водорода с кислородом, с образованием воды, стехиометрическое количество смеси называется гремучий газ, реагирует с мгновенным взрывом и большим выделением тепла, реакция соединения
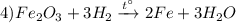
Взаимодействие оксида железа (III) с водородом при нагревании, с образованием железа и воды, возможен вариант взаимодействия с углем, алюминием или угарным газом, реакция замещения
ответ:1. Запишем уравнение реакции:
2C2H6 + 7O2 = 4CO2 + 6H2O.
2. Найдем количество вступившего в реакцию этана (Vm - молярный объем, постоянная, равная 22,4 л/моль):
n(C2H6) = V(C2H6) / Vm = 2 л / 22,4 л/моль = 0,089 моль.
3. По уравнению реакции найдем количество, а затем объем прореагировавшего кислорода:
n(O2) = n(C2H6) / 2 * 7 = 0,089 моль / 2 * 7 = 0,3125 моль.
V(O2) = n(O2) * Vm = 0,3125 моль * 22,4 л/моль = 7 л.
ответ: V(O2) = 7 л.
Объяснение: