1.На картинке
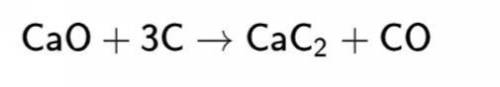
2.CaC2+2H2O→C2H2↑+Ca(OH)2
3.C2H2 +H2(t,Ni)→C2H4
C2H4+HCI→C2H5CI
C2H5CI+NaOH(t,p)→C2H5OH+NaCI
C2H5OH+CuO(t)→CH3COH
CH3COH+Ag2O(t)→CH3-COOH+2Ag↓
CH3COOH+C3H7OH(H)→CH3-COOC3H7+H2O
CH3-COOC3H7+H2O→CH3COOH +C3H7OH
1.CH3COONa + NaOH ----> CH4 + Na2CO3
2.2CH4(1500°C)→C2H2+3H2
3.C2H2+H2O(H+,Hg2+)→CH3COH
4.CH3CHO + [O] → CH3COOH
5.CH3COOH+C4H9OH(H+)→CH3COOC4H9 +H2O
6.CH3COOC4H9+H2O(H+)→CH3COOH+C4H9OH
7.C4H9OH +HCI→C4H9CI +H2O
8.C4H9Cl+CH3Cl+2Na->C5H12+2NaCl
9.C5H12 (t,катализатор Pt)-> C5H10+H2
10.C5H10+Br2->C5H10Br2
11.C5H10Br2 +2NaOH→C5H10(OH)2 +2NaBr
12.C5H10(OH)2+Na→C5H10(ONa)2 +H2
1.Метан
2.Ацетилен
3.Этаналь
4.Уксусная кислота
5.Уксуснобатновый эфир
6.Бутанол
7.Хлорбутан
8.Пентан
9.Пентен
10.Бромпентен
11.Пентендиол(точно не могу сказать,какие цифры)
12.Пентенат натрия(Точного названия нет)
Ps.В 11 и 12 может быть неправильно,если кто-то захочет - то скажите,где ошибка

1.Название
2.Химический знак, относительная атомная масса (Ar)
3.Порядковый номер
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы "А" - Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d- элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.