5. Для гидроксида железа (II) НЕ характерна реакция:
A. с раствором соляной кислоты;
Б. с сульфатом бария;
B. разложения при нагревании.
ответ:
6. Вещество, вступающее в реакцию с раствором фосфорной кислоты:
A. Гидроксид натрия.
Б. Оксид серы (IV).
B. Хлорид калия.
ответ:
8. Реакция ионного обмена протекает между растворами веществ:
А. хлорид бария и соляная кислота;
Б. нитрат калия и сульфат железа (II);
В. нитрат серебра и хлорид калия.
ответ:
9. Установите соответствие:
формула вещества:
1) Ba(NO 3 ) 2 ,
2) SO 3 ,
3) H 2 SO 4 ,
4) FeO,
5) NaOH;
класс вещества:
а) кислота,
б) основание,
в) кислотный оксид,
г) основный оксид,
д) соль.
ответ:
11. Запишите уравнения химических реакций согласно схеме:
Zn → ZnCl 2 → Zn(OH) 2 → ZnO .
Для второй реакции запишите полное и сокращённое ионные уравнения.
Для первой реакции составьте схему электронного баланса, укажите окислитель и
восстановитель.
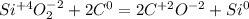
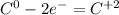 · 2 восстановитель процесс окисления
· 2 восстановитель процесс окисления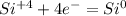 · 1 окислитель процесс восстановления
· 1 окислитель процесс восстановления
5) Б
6) А
8) В
9) 1-д
2-в
3-а
4-г
5-б
11) Первую реакцию смотри в файле!
Вторую реакцию смотри в файле!
3) Zn(OH)2↓=ZnO+H2O (идёт под действием температуры t°)
Отметь мой ответ лучшим