1. ca(oh)2 + 2nacl = CaCl2 2naoh
caso4 + 2hcl = cacl2 + h2so4
2. ca(oh)2 + hcl = cacl2 + h2o
3. находятся в 1 группе главной подгруппе(А), очень мягкие при комнатных температура, можно резать ножом. легкоплавкие, легкие. на последней орбитале имеют 1 электон.
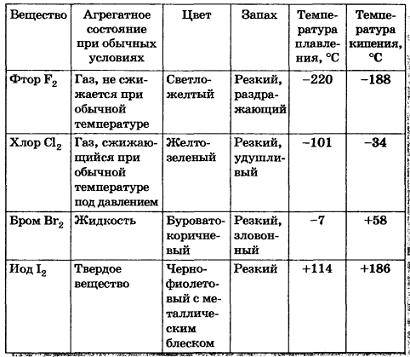
4. щелочные металлы - твердные, галогены - газы(летучие). В твердом состоянии Р2, Сl2, Вг2,I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами (см. вложение)
5. Практическое значение имеют главным образом Na2 SO4 (в технике часто называемый просто сульфат) и K2 SO4 , особенно первый из них. Важнейшим их потребителем является стекольная промышленность. Кристаллогидрат Na2 SO4 ·10H2 O («мирабилит», или «глауберова соль») применяется в медицине как слабительное.
___
Фтор применяют для синтеза фтороуглеродов - фреонов (они используются как хладоагенты и для распыления аэрозолей - красок, лаков и т.д.), химически стойких материалов - тефлонов (-CF2-CF2-). Фториды металлов находят применение при изготовлении оптических элементов - призм, фильтров, волоконных проводов для оптоэлектронной связи.
Хлор используют при получении хлоридов металлов и неметаллов (например, AlCl3 , FeCl3,, PCl3 и т.д.), соляной кислоты, различных хлорорганических соединений: растворителей - тетрахлорметана CCl4, трихлорэтилена CHCl-CCl2, антисептиков и инсектицидов - ДДТ (дихлородифенилтрихлорэтана), лекарственных препаратов (хлоральгидрата - снотворного, гексахлорафена - бактерицидного вещества), отбеливателей.
Бром и иод применяют в фотографии (галогениды серебра, свинца), при получении присадок к бензину (С2H4Br2), ингибиторов воспламенения, в галогенных лампах.
1) электролиты и неэлектролиты
2) С. Аррениус
3) а) Катио́н — положительно заряженный ион. Катионы притягиваются к отрицательному электроду — катоду
б) Анионы притягиваются к положительному электроду — аноду
в) Анион
г) Катио́н
4) Гидратированные ионы - это соединенные с молекулами воды. Они образуются при растворении электролитов в воде. 4.7.
5) Степень диссоциации — это отношение количества вещества электролита, распавшегося на ионы, к общему количеству растворённого вещества:
6) Степень диссоциации зависит от природы электролита и растворителя, концентрации раствора, температуры, присутствия одноименного иона и других факторов.
7) Слабые и сильные электролиты
8) 1) практически все соли;
2) сильные кислоты, например: серную, соляную, азотную;
3) все щёлочи.
9) к слабым электролитам относят:
1) слабые кислоты, например: сероводородную, угольную, азотистую, сернистую;
2) водный раствор аммиака.
11) NaOH = Na+ + OH -
H2SO4 = 2H+ + SO42-
Na2CO3 = 2Na+ + CO3 2-
KOH = K+ + OH -
H3PO4 = 3H+ + PO4 3-
BaCl2 = Ba2+ 2 Cl -
12) Zn + 2HCl = ZnCl2 замещения
2HgO =2 Hg + O2 разложения
SO3 + H2O = H2SO4 соединения
CuCl2 +2 NaOH = Cu(OH)2 + 2NaCl обмена.
Объяснение: