1. Спирти мають функціональну гідроксильну групу(-ОН), тільки одноатомні мають у своїй будові лише одну групу,а багатоатомні-дві або більше.
2.а) -ацетат цинка и водород(реакция замещения)
б) -метиловый эфир уксусной кислоты и вода(реакция обмена)
в) -ацетат натрия,вода и углекислый газ(реакция обмена)
3. До складу твердих жирыв входять залишки насичених вищих карбонових кислот(стеаринової або пальмітинової),а до рідких-залишки ненасичених вищих карбонових кислот(олеїнової).Тверді жири - це тваринні жири(крім риб'ячого),а рідкі - рослинні(крім пальмового масла).Жири в живих організмах виконують енергетичну роль(при окисненні жирів вивільняється майже в два рази більше енергії,ніж при окисненні такої ж кількості вуглеводів або білків),будівельну(входять до складу біологічних мембран),захисну(жир підшкірної клітковини захищає від механічних ушкоджень внутрішні органи)
4. Сахароза - це типовий дисахарид,який складається із залишків глюкози і фруктози.Тверда кристалічна речовина,добре розчинна у воді,трохи солодша на смак від глюкози.Поширена у природі у цукровому буряці та цукровій тростині,з яких і видобувають цукор(сахарозу).В присутності концентрованної сульфатної кислоті гідролізує(тобто взаємодіє з водою),в результаті утворюються глюкоза і фруктоза:
При повному окисненні утворюються вода і вуглекислій газ:
Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион:
M0 - M+
В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
Взаимодействие с неметаллами
Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий:
4Li + O2 = 2Li2O,
натрий образует пероксид:
2Na + O2 = Na2O2,
калий, рубидий и цезий – надпероксид:
K + O2 = KO2.
С галогенами все щелочные металлы образуют галогениды:
2Na + Cl2 = 2NaCl.
Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании:
с водородом образуются гидриды:
2Na + H2 = 2NaH,
с серой – сульфиды:
2K + S = K2S,
с фосфором – фосфиды:
3K + P = K3P,
с кремнием – силициды:
4Cs + Si = Cs4Si,
с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2,
калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом.
С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N.
Взаимодействие с водой
Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2M + 2H2O = 2MOH + H2.
Взаимодействие с кислотами
Щелочные металлы реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2.
Взаимодействие с органическими веществами
Щелочные металлы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Восстановление металлов из оксидов и солей
Менее активные металлы могут быть получены восстановлением щелочными металлами:
3Na + AlCl3 = Al + 3NaCl
щелочно земельные
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами, водородом и гелием. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и в большинстве соединений имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
1. Спирти мають функціональну гідроксильну групу(-ОН), тільки одноатомні мають у своїй будові лише одну групу,а багатоатомні-дві або більше.
2.а)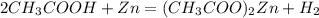 -ацетат цинка и водород(реакция замещения)
-ацетат цинка и водород(реакция замещения)
б)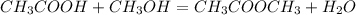 -метиловый эфир уксусной кислоты и вода(реакция обмена)
-метиловый эфир уксусной кислоты и вода(реакция обмена)
в)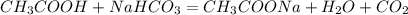 -ацетат натрия,вода и углекислый газ(реакция обмена)
-ацетат натрия,вода и углекислый газ(реакция обмена)
3. До складу твердих жирыв входять залишки насичених вищих карбонових кислот(стеаринової або пальмітинової),а до рідких-залишки ненасичених вищих карбонових кислот(олеїнової).Тверді жири - це тваринні жири(крім риб'ячого),а рідкі - рослинні(крім пальмового масла).Жири в живих організмах виконують енергетичну роль(при окисненні жирів вивільняється майже в два рази більше енергії,ніж при окисненні такої ж кількості вуглеводів або білків),будівельну(входять до складу біологічних мембран),захисну(жир підшкірної клітковини захищає від механічних ушкоджень внутрішні органи)
4. Сахароза - це типовий дисахарид,який складається із залишків глюкози і фруктози.Тверда кристалічна речовина,добре розчинна у воді,трохи солодша на смак від глюкози.Поширена у природі у цукровому буряці та цукровій тростині,з яких і видобувають цукор(сахарозу).В присутності концентрованної сульфатної кислоті гідролізує(тобто взаємодіє з водою),в результаті утворюються глюкоза і фруктоза:
При повному окисненні утворюються вода і вуглекислій газ: