1). Чему равна эквивалентная масса хрома в соединении Cr2O3? А. 50,7 Б. 34,6 В. 8,67 Г. 26 Д. 17,3
2). Вычислить массу (в г) 1 л фтора при н.у.
А. 0,85 Б. 1,7 В. 1,18 Г. 0,59 Д. 8,51
3). Как изменится время протекания химической реакции
Fe + H2O (газ) Fe3O4 + H2,
если увеличить объём газовой смеси в 2 раза?
А.ув. в 16 раз Б.ув. в 8 раз В.ув. в 128 раз Г.ум. в 16 раз Д.ум. в 128 раз
4). Сколько г кислоты содержится в 500 мл 80%-го раствора (пл. 1,1 г/мл)?
А. 8 г Б. 36 г В. 11 г Г. 440 г Д. 40 г
5). Сколько г соли содержится в 0,1 л 1М раствора Са(NО3)2?
А. 8,2 г Б. 1,64 г В. 16,4 г Г. 16,0 г Д. 82 г
6). Чему равно осмотическое давление раствора, содержащего 12 г уксусной кислоты в 200 мл раствора? Температура
раствора 10 оС.
А. 23,2 атм Б. 16,7 атм В. 22,4 атм Г. 11,2 атм Д. 12,1 атм
7). Раствор, содержащий 1,9 г МgСl2 в 100 г воды, кипит при 100,208 оС. Вычислить кажущуюся степень диссоциации
этой соли в растворе. Е (воды) = 0,52.
А. 25 % Б. 50 % В. 75 % Г. 83 % Д. 5 %
8). рН 0,01М раствора слабого однокислотного основания равен 9. Вычислить Кд. этого основания.
А. 109
Б. 2х109
В. 107
Г. 108
Д. 1010
9). Какая соль подвергается ступенчатому гидролизу?
А. К2СO3 Б. К2SO4 В. NаCN Г. CH3COOH Д. NH4Cl
10). Методом электронного баланса уравнять следующий окислительно-восстановительный процесс:
SnCl2 + KMnO4 + HCl H2SnCl6 + KCl + MnCl2.
Рассчитать эквивалент окислителя.
А. 94,5 Б. 31,6 В. 158 Г. 7,9 Д. 11
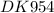
1. Хим. свойства спиртов:
спирты проявляют как кислотные так и основные свойства,
Кислотные свойства:
Спирты реагируют с щелочными металлами и растворами щелочей
с образованием алкоголят:
R-OH + Na = R-ONa + H2
R-OH + NaOH = R-ONa + H2O
Однако вообще кислотные свойства спиртов мало проявляются, ибо те алкоголяты что получились практически сразу гидролизуются .
Основные свойства:
R-OH + HCl = R-Cl + H2O
Группа OH замещается на галоген .
Спирты окисляются при горении образуя CO2 и H2O (как и обычные углеводороды) .
Спирты могут в присутствии катализаторов Ni/Pt и нагревании дегидрироватся , разделяют дегидрирование на 2 вида:
Внутримолекулярная:
R-OH(Ni, t > 140*C) = CnH2n + H2O (алкен + вода)
Межмолекулярная:
R-OH(Ni, t < 140*C) = CnH2n+2O + H2O (простой эфир + вода)
получения спиртов:
Гидрирование альдегидов либо кетонов, при гидрировании альдегидов получаем первичные спирты, при гидрировании кетонов - вторичные.
Алкен + вода (гидратация алкенов) .
Так-же для отдельных спиртов:
Брожение глюкозы при котором получаем этиловый спирт.
Получение метилового спирта из синтез-газа (CO+H2)
3. Хим.свойства фенолов:
Они почти такие же как и спирты, разве что кислотные свойства ярче выражены, например так-же при реакции с щелочными металлами и щелочными растворами образуются феноляты + водород либо вода .
4. Из альдегидов при гидрировании получают первичные спирты, при гидратации - вещества которые называют гидраты, они существуют при низкой температуре , так-же из них получают полуацетали присоединением спиртов, это тоже типа вещества существующие при низкой температуре. При жёстком окислении из них получают карбоновые кислоты . При реакции с галогенами - получают лекарственные вещества (к примеру тот же хлорат) .
5. Непонятное условие, абсолютно несвязанная информация.