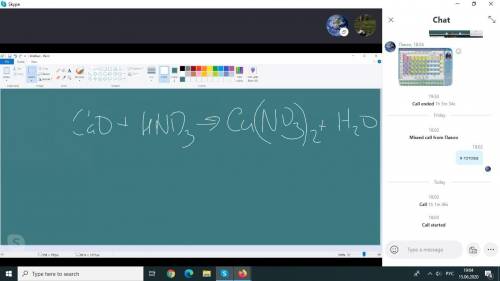
дано
m(HNO3) = 15 g
m(Ca(NO3)2) - ?
CaO+2HNO3-->Ca(NO3)2+H2O
M(HNO3) = 63 g/mol
n(HNO3) = m/M = 15 / 63 = 0.24 mol
2n(HNO3) = n(Ca(NO3)2) = 0.24 / 2 = 0.12 mol
M(Ca(NO3)2) = 164 g/mol
m(Ca(NO3)2) = n*M = 0.12 * 164 = 19.68 g
ответ 19.68 г
Объяснение:
SO₂оксид серы(IV) кислотный оксид:
Качественный состав: сера и кислород
Количественный состав: 1атом серы,2атома кислорода,
сложное вещество,
Mr(SO₂)=32+32=64
ω(S)=32÷64=0,5 ω%(S)=0,5×100%=50%
ω(O)=32÷64=0,5 ω%(O)=0,5×100%=50%
SO₃ оксид серы(VI) кислотный оксид:
Качественный состав: сера и кислород.
Количественный состав: 1атом серы,3атома кислорода
сложное вещество,
Mr(SO₃)=32+48=80
ω(S)=32÷80=0,4 ω%(S)=0,4×100%=40%
ω(O)=48÷80=0,6 ω%(O)=0,6×100%=60%
Взаимодействуют:
с водой
SO₂+H₂O=H₂SO₃
SO₃+H₂O=H₂SO₄
с основными оксидами
SO₂+Na₂O=Na₂SO₃
SO₃+Na₂O=Na₂SO₄
с основаниями
SO₂+2Na(OH)=Na₂SO₃+H₂O
SO₃+2Na(OH)=Na₂SO₄+H₂O
Дано:
m(CH₄)=32г
Q=892кДж
Q₁-?
1. Находим молярную массу метана:
M(CH₄)=12+4=16г./моль
2. Находим количество вещества метана массой 32г.:
n₁(CH₄)=m(CH₄)÷M(CH₄)=32г.÷16г./моль=2моль
3. Запишем уравнение реакции горения метана:
CH₄+O₂=CO₂+H₂O+892кДж
n(CH₄)=1моль Q=892кДж
по уравнению реакции: горит метан количеством вещества 1моль и выделяется 892кДж.
по условию задачи:
n(CH₄)=2моль Q₁=892кДж х 2=1784кДж
Значит, если по условию задачи, горит 2моль метана то теплоты выделится в два раза больше: 1784кДж
4. ответ: при сгорании 32г. метана выделяется 1784кДж тепла.
Сначала уравняем реакцию:
HNO3-азотная кислота
15грх
2HNO3+CaO=Ca(NO3)2+H2O
(2×63)гр164гр
х=(164×15)÷126= 19,5гр
ответ: Са(NO3)2 - нитрат кальция - 19,5гр