
Объяснение:
Как они расставили индексы у я не понимаю
Алюминий по разному реагирует с разбавленной и концентрированной серной кислотой
В реакции с разбавленной серной кислотой, окислителем служат протоны водорода, восстановителем - алюминий:
0 +1 +3 0
2Аl + 3H2SO4 (p) = Al2(SO4)3 + 3H2↑
Эта реакция окислительно-восстановительная, поэтому если нет навыка нужно обязательно расставлять коэффициенты на основе электронного баланса: сколько электронов отдают атомы восстановителя, столько же электронов принимают атомы окислителя.
2Al⁰ - 6e = 2Al⁺³ окисление, Al⁰ - восстановитель ║ 1
2Н⁺ + 2е = Н₂⁰ восстановление, 2Н⁺ - окислитель ║3
Аналогично протекают реакции между алюминием и соляной кислотой и другими кислотами - неокислителями.
Кислоты - окислители ( концентрированнная серная кислота, разбавленная и концентрированная серная кислота и другие)
в обычных условиях на алюминий не действуют. Эти кислоты пассивируют алюминий. Оксидная пленка на поверхности алюминия становится более плотной и прочной и едва возникший ОВ-процесс тут же прекращается.
Но в жестких условиях (например при нагревании кислоты-окислители разрушают алюминий: окислителями в этом случае выступают не ионы водорода, а ионы кислотообразующего атома (в примере с концентрированной серной кислотой - сульфат-ионы):
И снова это ОВР - поэтому необходимо составлять электронный баланс:
0 +6 +3 +4
2Al + 6H2SO4 (конц) = Al2(SO4)3 + 3SO2↑ + 6H2O
2Al⁰ - 6e = 2Al⁺³ окисление, Al⁰ - восстановитель ║1
S⁺⁶ + 2e = S⁺⁴ восстановление, S⁺⁶ - окислитель ║ 3
Согласно электронного баланса 3 моль серной кислоты расходуется на ОВ-процесс и еще 3 моль серной кислоты необходимо для связывания ионов алюминия.
Аl + H2SO4 > Al2(SO4)
Дано:
ω(HNO3)= 25% = 0,25
m(Ca(OH)2)= 18,5 г.
Найти : m р-ра (HNO3)= ? m(Сa(NO3)2) = ?
1) 2HNO3 + Ca(OH)2 = Сa(NO3)2 + 2H2O
Mr(Ca(OH)2) = 74 г/моль
n(Ca(OH)2) = m/Mr = 18,5 / 74 = 0,25 моль
2) n (HNO3) = n(Ca(OH)2) * 2 = 0,25 моль * 2 = 0,5 моль
Mr (HNO3) = 63 г/моль
m в-ва (HNO3) = n * Mr= 0,5 моль * 63 г/моль = 31,5 г
m р-ра (HNO3)= m в-ва (HNO3) / ω(HNO3) = 31,5 г / 0,25 = 126 г
3) n(Сa(NO3)2) = n(Ca(OH)2) = 0,25 моль
Mr (Сa(NO3)2) = 164 г/моль
m (Сa(NO3)2) = n(Сa(NO3)2) * Mr (Сa(NO3)2) = 0,25 моль * 164 г/моль = 41 г
ответ: m р-ра (HNO3)=126 г ; m (Сa(NO3)2) = 41 г.
Объяснение:
Объяснение:
Циклобутан->(HBr)->Х1->(KOH(спирт.))X2->(Br2)Х3->2(KOH(спирт.))Х4->(KMnO4/H2SO4)Х5
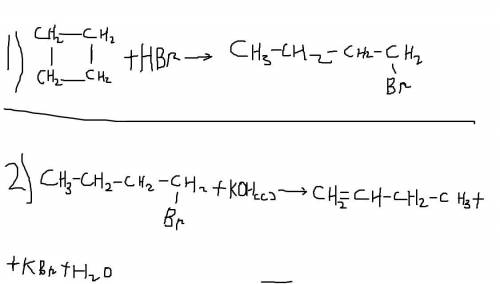
1)Для циклобутана и циклопропана характерно с разрывом цепи. ( структурные приложу с фото )
C4H8+HBr->C4H9Br ( 1-бромбутан )
2)Обычная реакция дегидрогалогенирования
С4H9Br+KOH(с)->С4H8+KBr+H2O ( бутен - 1 )
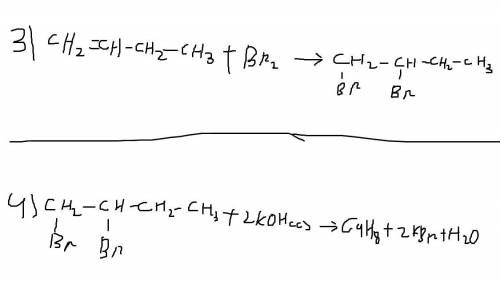
3)Обычная реакция галогенирования ( с разрывом двойной связи )
C4H8+Br2->C4H8Br2 ( 1,2 - дибромбутан )
4)Обычная реакция дегалогенирования
С4H8Br2+2KOH(с)->C4H8+2KBr+H2O ( тут важно, что это бутен-1, с бутен- 2 окисление идет по-другому )
5)Окисление перманганатом калия в кислой среде
C4H8 + 2KMnO4 + 3H2SO4 -> C2H5COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
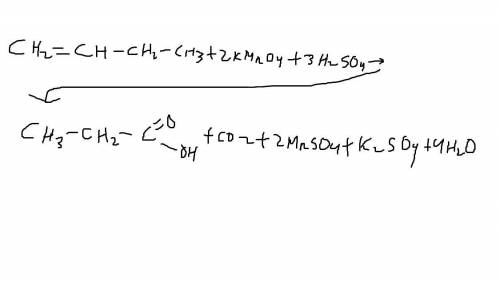
Відповідь:
AI - 3-ех валентный
SO4 - 2-ех валентный, т.к. у кислоты H2SO2 2 H
Поэтому до AI нужно прицепить 2 SO4 . Т.к. остается еще одна свободная, то нужно повторить еще раз, пока не останеться свободных