[Ag⁺] = 10⁻³моль/л
Объяснение:
ЭДС гальванического элемента рассчитывают как разность равновесных потенциалов катода и анода:
Е= Ек – Еа.
катодом является электрод, имеющий больший потенциал восстановления. Находим по таблицам:
Е°Ag⁺/Ag= +0,799 B
E°Fe²⁺/Fe= - 0,440 B
По уравнению Нернста:
E=E° + (0,059/n)*lg[Mezⁿ⁺]
Ек= 0,799 + (0,059/1)*lg[Ag⁺]
Ea= - 0,440+(0,059/2)*lg(10⁻³)= -0,5285В
[Ag⁺] = x
Е= Ек - Еа = 0,799 + (0,059/1)*lg(x) - (-0,5285) = 1,152
Ек = Е + Еа = 1,152В - 0,5285В = 0,6235В
Ек = 0,799 + (0,059/1)*lgx = 0,6235
lg(x) = - 2.97
х = 10⁻³моль/л; [Ag⁺] = 10⁻³моль/л
Объяснение:
Опыт1. Все вещества можно определить с свежеосаждённого гидроксида меди (II)
а) при его добавлении в пробирку с раствором глицерина будет наблюдаться растворение гидроксида меди (II), и окрашивание раствора в ярко-синий цвет (снимок№1)
б) при его добавлении в пробирку с раствором уксусной кислоты будет наблюдаться растворение гидроксида меди (II), и синие окрашивание гидроксида меди (II) исчезнет. Произойдет реакция нейтрализации:
2CH₃COOH+Cu(OH)₂=(CH₃COO)₂Cu+2H₂O
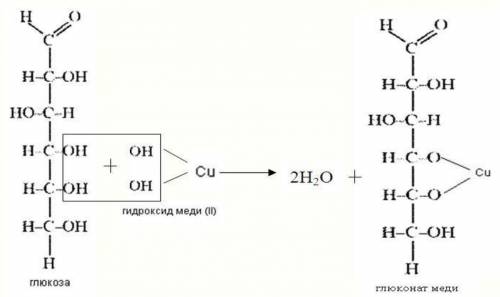
в) Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu₂O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
CH₂OH-CH(OH)₄-COH + Cu(OH)₂→CH₂OH-CH(OH)₄-COOH+Cu₂O↓+H₂O
Опыт2. На кусочек картофеля, хлеба и рис капнем капельку иодной настойки, иодная настойка приобретет синий цвет это и есть качественная реакция на крахмал.
ответ: CH3-C(O)-NH4
Объяснение: