Азот - неметалл. Азот это элемент 5 группы 2 периода периодической системы химических элементов Д.И. Менделеева Порядковый номер-7 Электронное строение атома 1s2 2s2 2p3. В соединениях проявляет степени окисления от -3 до +5.
Относительная томная масса=14, заряд ядра - +7, число энергетических уровней=2
p=7, e=7,n=Ar-p=14-7=7.
Азот имеет 2 стабильных изотопа 14N и 15N.
Соединение с высшей степенью окисления(+5) N2O5 - кислотный оксид С низшей (-3) летучее водородное соединение - NH3 основного характера
Получено 19,6 г сульфата хрома (III) Cr₂(SO₄)₃ и 3,36 л водорода
Объяснение:
Дано: m(Cr) = 5,2 г; m(H₂SO₄) = 98 г.
Найти: m(Cr₂(SO₄)₃); V(H₂).
Решение.
2Cr + 3H₂SO₄ → Cr₂(SO₄)₃ + 3H₂
По уравнению реакции хром и серная кислота реагируют в отношении 2 моль : 3 моль. Найдем количество вещества в заданных массах:
Молярная масса M(Cr) = 52 г/моль
Количество вещества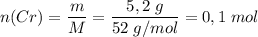 .
.
M(H₂SO₄) = 2 + 32 + 64 = 98 г/моль
На 0,1 моль Cr требуется 0,15 моль H₂SO₄. Серная кислота дана в избытке. Расчет ведем по хрому.
По уравнению реакции
n(Cr) : n(Cr₂(SO₄)₃) : n(H₂) = 2 : 1 : 3 = 0,1 моль : 0,05 моль : 0,15 моль
Найдем массу образовавшегося сульфата хрома (III) Cr₂(SO₄)₃
M(Cr₂(SO₄)₃) = 2*52 + 32*3 + 16*4*3 = 104 + 96 + 192 = 392 г/моль
m(Cr₂(SO₄)₃) = n*M = 0,05 моль * 392 г/моль = 19,6 г.
Найдем объем выделившегося водорода:
V(H₂) = n*Va = 0,15 моль * 22,4 л/моль = 3,36 л.