 моль
моль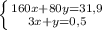
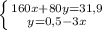

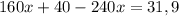

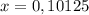 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)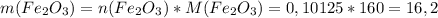 г
г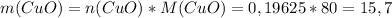 г
г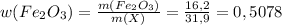 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)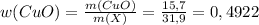 или 49,22%
или 49,22%1.
Калий йодида KI - вещесто с ионным типом связи и ионной кристаллической решеткой. Для калий иодида характерны свойства:
а) калий иодид имеет высокую температуру плавления и низкую летучесть;
б) калий иодид имеет низкую электрическую проводимость в кристаллическом состоянии;
в) калий иодид тверд, но хрупок;
г) калий иодид хорошо растворим в воде;
д) калий иодид в растворе или расплаве проводит электрический ток. Диссоциирует на ионы: KI⇄K⁺+I⁻
2.
Аммиак NH₃ - в аммиаке полярная ковалентная связь. Молекулярный тип кристаллической решетки. Для аммиака характерны свойства:
а) аммиак газ, летуч ;
б) аммиак легче воздуха;
в) аммиак сжижается при понижении температуры;
в) аммиак хорошо растворяется в воде, раствор аммиака в воде гидроксид аммония, фенолфталеин в растворе аммиака становится малиновым:
NH₃+H₂O⇄NH₄OH
С6Н12О6=2С2Н5ОН+2СО2
n(C6H12O6)=3,6 г/180г/моль=0,02 моль
По УХР С2Н5ОН в два раза больше, т.е. n(C2Н5ОН)=0,02*2=0,04 моль
m(C2H5OH)=0,04 моль * 46 г/моль=1,84 г
V=m/p
V(C2H5OH)= 1,84г/0,789 г/см3=2,33 г
Обычно в таких задачах даётся плотность вещества...