ответ сделай лучший ответ
Забруднення є актуальною темою сьогодні. День за днем екологія руйнується людьми, що забруднюють її, та використовують надмірні обсяги запасів.
проблеми забруднення довкілля:
викиди з фабрик/транспорту,
неутилізовані поліетиленові продукти,
токсичні домішки в їжі та предметах побуту.
Шляхи роз'вязку:
нам треба викидать сміття у спеціально відведених місцях.
зменшити кількість виробництва та споживання енергії та токсичних виробів.
зберігати навколишнє середовище за до фасувальних контейнерів.
элементарные частицы, атом, молекула — всё это объекты микромира, не наблюдаемого нами. в нём действуют иные законы, чем в макромире, объекты которого мы можем наблюдать или непосредственно, или с приборов (микроскоп, телескоп и т. поэтому, обсуждая далее строение электронных оболочек атомов, будем понимать, что мы создаём своё представление (модель), которое в значительной степени соответствует современным , хотя и не является абсолютно таким же, как у учёного-. наша модель .
электроны, двигаясь вокруг ядра атома, образуют в совокупности его электронную оболочку. число электронов в оболочке атома равно, как вы уже знаете, числу протонов в ядре атома, ему соответствует порядковый, или атомный, номер элемента в таблице д. и. менделеева. так, электронная оболочка атома водорода состоит из одного электрона, хлора — из семнадцати, золота — из семидесяти девяти.
как же движутся электроны? хаотически, подобно мошкам вокруг горящей лампочки? или же в каком-то определённом порядке? оказывается, именно в определённом порядке.
электроны в атоме различаются своей энергией. как показывают опыты, одни из них притягиваются к ядру сильнее, другие — слабее. главная причина этого заключается в разном удалении электронов от ядра атома. чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки, а вот чем дальше они от ядер, тем легче их оторвать. очевидно, что по мере удаления от ядра атома запас энергии электрона (е) увеличивается (рис. 38).
электроны, движущиеся вблизи ядра, как бы загораживают
максимальное (наибольшее) число электронов, находящихся на энергетическом уровне, можно определить по формуле: 2n2, где n — номер уровня. следовательно, первый энергетический уровень заполнен при наличии на нём двух электронов (2 × 12 = 2); второй — при наличии восьми электронов (2 × 22= 8); третий — восемнадцати (2 × з2 = 18) и т. д. в курсе 8—9 классов мы будем рассматривать элементы только первых трёх периодов, поэтому с завершённым третьим энергетическим уровнем у атомов мы не встретимся.
число электронов на внешнем энергетическом уровне электронной оболочки атома для элементов главных подгрупп равно номеру группы.
теперь мы можем составить схемы строения электронных оболочек атомов, руководствуясь планом:
а) определим общее число электронов на оболочке по порядковому номеру элемента; б) определим число заполняемых электронами энергетических уровней в электронной оболочке по номеру периода; в) определим число электронов на каждом энергетическом уровне (на 1-м — не больше двух; на 2-м — не больше восьми, на внешнем уровне число электронов равно свою в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. изобразите схемы строения электронной оболочки атомов: а)
1) Ar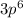 N = 3 L = 1 Ml = 1 Ms = -½
N = 3 L = 1 Ml = 1 Ms = -½
2) Na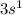 N = 3 L = 0 Ml = 0 Ms = +½
N = 3 L = 0 Ml = 0 Ms = +½
3) Mg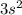 N = 3 L = 0 Ml = 0 Ms = -½
N = 3 L = 0 Ml = 0 Ms = -½
4) Al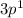 N = 3 L = 1 Ml = -1 Ms = +½
N = 3 L = 1 Ml = -1 Ms = +½
Объяснение:
Главное квантовое число N характеризует энергетический уровень, другими словами это размер энергетического уровня, чем больше число N - тем больше радиус, на котором находятся электроны.
Орбитальное квантовое число L обозначает форму той области, в которой может находится электрон, число L имеет значения s (L=0),p (L=1), d (L=2),f (L=3) и также называется энергетической оболочкой или энергетическим подуровнем.
На каждой орбитали находится «2·L + 1» орбиталей, магнитное квантовое число Ml обозначает орбиталь, на котором находится электрон. Ml может принимать значения ±L.
И последнее квантовое число - спин, он принимает два значения: +½ и -½, обозначающий соответственно прямое и обратное вращение электрона.
Квантовые числа элемента, или квантовые числа электрона - это четыре квантовых числа, характеризующих состояние внешнего электрона в атоме.