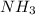 , сближающая его с щелочами, является хорошая "принимать" атомы водорода.
, сближающая его с щелочами, является хорошая "принимать" атомы водорода.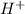 (а точнее
(а точнее 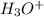 - катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь
- катион водорода чрезвычайно активен и "липнет" к чему угодно, что может его взять) резко падает. Аммиак "перетягивает одеяло" даже у нейтральной воды (тем самым образуя смесь 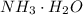 , которая в общем-то может образовать ионы
, которая в общем-то может образовать ионы 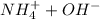 , хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).
, хотя говорить о гидроксиде аммония не принято - потому что эта "соль" существовать только в растворах).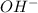 (к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
(к слову - растворимость у всех реально существующих солей аммония очень похожа на растворимости солей щелочных металлов, что также указывает на некое сходство), оба этих раствора выступать как акцепторы (т.е. "принимающие", "отнимающие") водород.
CuSO4 сульфат меди (II) (соль)
HNO2 -азотистая кислота
SO3-оксид серы (VI),
Fe(OH)2-гидроксид железа (II)
K2SO4-cульфат калия
KOH-гидроксид калия
HNO3-азотная кислота
2.H2SiO3-кремниевая кислота(степень окисления водорода +1,кислорода-2,кремния +4),соответствующий ей оксид SiO2
Fe(OH)2-гидроксид железа (II)соответствующй оксид FeO
Al2(SO4)3-сульфат алюминия,соответствующий оксид Al2O3,гидроксид Al(OH)3
3.оксид углерода (IV)СО2 молярная масса его=44г\моль
44г занимает объём 22,4 литра
132000гХ
Х=132000Х22,4\44=67200 литров,или 67,2 куб.м
Число молекул будет равно 132000\44х6,02х10*23=18060х10*23=1,806х10*27 молекул