х г 12 л
106 г 22,4 л
1. Знайдемо чисту масу кальцинованої соди:
при взаємодіїї 106 г соди віділяється 22,4 л вуглекислого газу, а
при -- // -- х г_________________12 л, звідки
х=106*12/22,4=57 г
2. Тепер,віднявши від загальної маси зразка отриману чисту масу соди,отримаємо масу домішків:
m(домішків)=m(зразка) - m(Na2CO3)=68 - 57 =11 г
3. Віднесемо масу домішків до загальної маси зразка і отримаємо масову частку домішків:
w(домішків)=m(домішків)/m(зразка)=11/68=0,16 або 16%
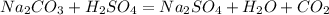
Відповідь:
Пояснення:Дано: m(розчину)= 300 г; ω(речовини)=0,02 або 2%.
Знайти: m(речовини)-?
Розв'язання:
б.
З формули ω(речовини)=m(речовини)/m(розчину) знаходимо
m(речовини)=ω(речовини)•m(розчину)
m(речовини)=0,02 • 300 г = 6 г.
б.
Складемо пропорцію і розв'яжемо її для обчислення маси речовини.
Те, що масова частка речовини рівна 2% означає, що
у 100 г розчину міститься 2 г речовини, тоді
у 300 г розчину буде міститися х г речовини.
100 г / 300 г = 2 г / х г, звідси
х • 100 г = 2 г • 300 г,
х = 2 г • 300 г / 100 г = 6 г.
2)
Объяснение:
3K2O + P2O5 =2 K3PO4 (реакция соединения)