Li
1s2 2s1
Fe
1s2 2s2 2p6 3s2 3p6 3d6 4s2
посмотри видео на Ютубе там есть
Объяснение:
Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле
Аr(Э) • z
——————
Mr(вещ.)
Молекулярная масса вещества
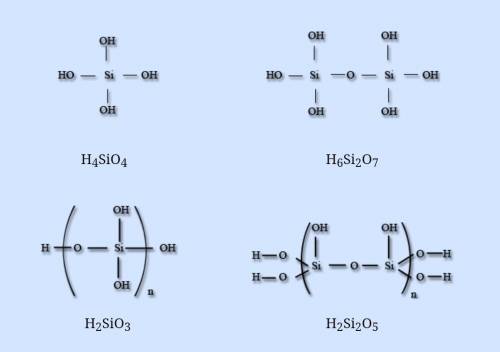
Кремниевые кислоты – соединения оксида кремния с водой, очень слабые нерастворимые кислоты. Соотношение оксида кремния и воды различно, общая формула nSiO2·mH2O, кислоты легко переходят друг в друга. В водных растворах доказано существование ортокремниевой H4SiO4, пирокремниевой H6Si2O7, метакремниевой H2SiO3 и дикремниевой H2Si2O5 кислот
Получают кремниевые кислоты косвенным путем, действуя на силикат калия или натрия соляной кислотой Получение кремневой кислоты:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl.
Их нельзя получить в чистом виде.
Соли кремниевой кислоты – силикаты. Обычно они нерастворимы в воде, исключения составляют силикаты натрия и калия, их называют «жидким стеклом». Силикаты широко распространены в природе. Свойства силикатов различны в зависимости от их состава и строения, очень часто они имеют красивую окраску, некоторые из них используются в ювелирном деле (гранат, топаз, изумруд).
Силикаты широко распространены в природе. Они имеют различный состав и строение. Практически все силикаты содержат структурную единицу – кремнийкислородный тетраэдр SiO4. В структуре силикатов атомы кремния могут замещаться на атомы алюминия, в этом случае образуются алюмосиликаты. По строению силикаты и алюмосиликаты делятся на следующие классы: островные, цепочечные, ленточные, слоистые и каркасные.
Стекло – тоже силикат. Состав обычного оконного стекла: Na2O·CaO·6SiO2. Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 = Na2O·CaO·6SiO2 + 2CO2.Получение силикатов
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато–лиловый.
Электронную конфигурацию атома лития можно записать двояко:
+3 Li)2)1;
1s22s1.
Литий, так же, как и водород и гелий относится к семейству s-элементов. Энергетическая диаграмма атома лития (на ней изображаются только валентные электроны) имеет вид:
Энергетическая диаграмма атома лития
В результате химического взаимодействия литий теряет свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион (Li+):
Li0 –e → Li+;
В соединениях литий проявляет степень окисления +1.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p5.
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
Энергетическая диаграмма для валентных электронов
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F—):
F0 +e →F—.