Используя правило Клечковского написать электронную формулу. По электронной формуле это определяется легко. Например, электронная формула углерода 1s2 2s2 2p2, видим что на s-орбиталях по 2 электрона, т. е. они спарены. На p- орбиталях 2 электрона, но 2-р орбиталей три. Значит по правилу Гунда, 2 электрона займут 2 разных р-орбитали, и у углерода - 2 неспаренных электрона. Аналогично рассуждая видим, что у атома азота 1s2 2s2 2p3 - 3 неспаренных электрона. У кислорода 1s2 2s2 2p4 - на р-орбиталях 4 электрона. 3 электрона расположились по одному на разных р-орбиталях, а четвертому отдельного места нет. Поэтому он идет в пару к одному из трех, а два остаются неспаренными. Аналогично у фтора 1s2 2s2 2p5 - один неспаренный электрон, а у неона 1s2 2s2 2p6 нет неспаренных электронов. Совершенно аналогично нужно рассматривать и d- и f- орбитали (если они задействованы в электронной формуле, и не забывать, что d-орбиталей пять, а f-орбиталей семь.
32
32
Нравится
Объяснение:
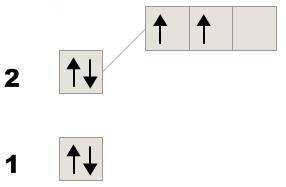
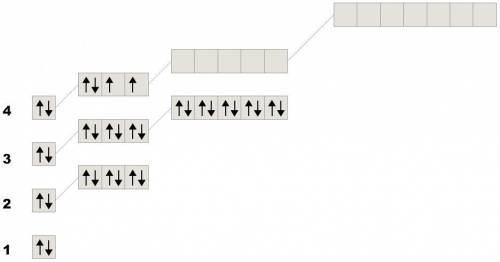
Якщо електрони у першого розміщенні на 2 енергетичних рівнях, значить це елемент другого періоду. Всього на зовнішньому рівні елементів другого періоду може бути 8 електронів, тому робимо висновок, що цей елемент має 4 електрони і ще 4 йому треба, щоб завершити рівень
Значить це Карбон (електронно-графічна формула рис. 1)
У другого елемента енергетичних рівнів на 2 більше, значить всього їх 4, тобто це елемент 4 періоду. Якщо для завершення зовнішнього рівня не вистачає 2 електрони, значить вже є 6
Значить це Селен (електронно-графічна формула рис. 2)
4)12 атомов
Объяснение:
одна молекула воды состоит из двух атомов водорода и одного атома кислорода, значит 4 молекулы воды содержат 4*3 = 12 атомов