ОбъяЦи́кл трикарбо́новых кисло́т (сокр. ЦТК, цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́[1][2]) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные[en] остатки (СН3СО-) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 НАДН, 1 ФАДH2 и 1 ГТФ (или АТФ)[3]. Электроны, находящиеся на НАДН и ФАДH2, в дальнейшем переносятся на дыхательную цепь[2], где в ходе реакций окислительного фосфорилирования образуется АТФ.
Цикл трикарбоновых кислот — это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме, промежуточный этап между гликолизом и электронтранспортной цепью. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения, как аминокислоты, углеводы, жирные кислоты и др.[4]
Цикл превращения лимонной кислоты в живых клетках (то есть цикл трикарбоновых кислот) был открыт и изучен немецким биохимиком Хансом Кребсом, за эту работу он (совместно с Ф. Липманом) был удостоен Нобелевской премии (1953 год)[1].
У эукариот все реакции цикла Кребса протекают внутри митохондрий, а у большинства бактерий реакции цикла протекают в цитозоле[5].
снение:
Объяснение:
Расположите вещества в порядке убывания рН их водных растворов одинаковой концентрации: Na2SO4, HCl, CH3COOK, Fe(NO3)3, Ba(OH)2
Na2SO4 средняя соль - рН - близкая к нейтральной (≈ 7)
HCl - сильная кислота рН в кислом интервале (рН 1-2)
CH3COOK - соль слабой кислоты и сильного основания в растворе подвергается гидролизу по аниону (рН 8-9)
Fe(NO3)3 соль слабого основания и сильной кислоты в растворе подвергается гидролизу по катиону (рН 5-6)
Ba(OH)2 сильное основание (щелочь) - рН 10-11
Тогда эти вещества можно расположить в порядке убывания рН
(усиления кислотных свойств)
Ba(OH)2 --> CH3COOK --> Na2SO4 --->Fe(NO3)3 ---> HCl
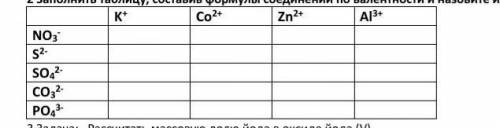
KNO3, K2S, K2SO4, K2CO3, K3PO4,
Co(NO3)2, CoS, CoSO4, CoCO3, Co3(PO4)2,
Zn(NO3)2, ZnS, ZnSO4, ZnCO3, Zn3(PO4)2,
Al(NO3)3, Al2S3, Al2(SO4)3, Al2(CO3)3, AlPO4
Объяснение:
Смотришь на валентности, если один из них чётный, а другой нечётный, то ставишь число валентности вещества или элемента, как индекс к противоположному. Если оба четные или оба нечётные, то сокращаешь числа валентностей и ставиш как индекс