1.
А. 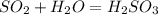
Б. 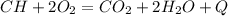
В. 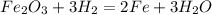
1.
А. 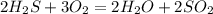
Б. 
В. 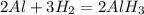
2.
mH2O = 35г
mсоли = 10г
mраствора = mсоли+mводы = 35г+10г = 45г
w = mсоли/mр-ра = 10г/45г*100% = 22,2%
2.
mр-ра = 300г
wсоли = 0,05
mсоли = w*mр-ра = 0,05*300г = 15г
mводы = mр-ра - mсоли = 300-15 = 285г
3.
C -> XH4 -> CO2 -> H2CO3
1. C + 2H2 = CH4 - соединение, обр. метан
2. CH4 + 2O2 = CO2 + 2H2O - разложение, с образованием углекислого газа и воды.
3. CO2 + H2O = H2CO3 - соединение, обр. уголная кислота
3.
Al -> Al2O3 -> Al -> Al(OH)3
1. 4Al + 3O2 = 2Al2O3 - соединение, обр. оксид алюминия.
2. 2Al2O3 --эл. ток--> 4Al + 3O2 - разложение, обр. алюминий и кислород
3. 2Al + 6H2O = 2Al(OH)3 + 3H2 - замещение, обр. гидроксид алюминия и водород.
Объяснение:
1)
А SO₂ S+O₂=SO₂
Б S
2)
Використовується сірки оксид (IV) для отримання сірки оксид (VI), яка використовується для отримання сірчаної кислоти
3)
В природі зустрічається сірка:
1) Самородна сірка.
2) Сульфідна сірка:
FeS₂-сірчаний або залізний колчедан, пірит.
CuS-мідний блиск.
CuFeS₂-халькопірит або мідний колчедан.
PbS - свинцевий блиск.
ZnS-цинкова обманка.
HgS-кіновар.
3) Сульфатна сірка:
CaSO₄x2H₂O-гіпс.
CaSO₄xH₂O-алебастр.
Na₂SO₄x10H₂O-глауберова сіль.
MgSO₄x 7H₂O-гірка сіль.
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесе,растворим в спирте и бензоле. Ткип = -192 °C; Тпл = -205 °C. Ядовит.
В химическом отношении – инертное вещество. Относится к несолеобразующим оксидам, не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты:
CO + NaOH = HCOONa,
что позволяет формально рассматривать его как ангидрид муравьиной кислоты.
Взаимодействие с кислородомПри нагревании в кислороде сгорает красивым синим пламенем:
2СО + О2 = 2СО2.
Взаимодействие с водородомРеагирует с водородом:
СО + Н2 = С + Н2О.
Взаимодействие с другими неметалламиПри облучении и в присутствии катализатора взаимодействует с галогенами:
СО + Cl2 = COCl2 (фосген).
и серой при 350° C:
СО + S = COS (карбонилсульфид).
Восстановительные свойстваСО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C+2O + CuO = Сu + C+4O2.
Взаимодействие с переходными металламиС переходными металлами образует карбонилы:
Ni + 4CO = Ni(CO)4;
Fe + 5CO = Fe(CO)5.
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом.
Химически оксид углерода (IV) инертен.
Окислительные свойстваС сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа:
С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C.
Свойства кислотного оксидаТипичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O + CO2 = Na2CO3,
2NaOH + CO2 = Na2CO3 + H2O,
NaOH + CO2 = NaHCO3.
Качественна реакцияКачественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2.