Na2SO4 + BaCl2 = 2NaCl + BaSO4, последний продукт - сульфаи бария - вещество не растворимое, значит можно смело писать ионное уравнение, как его писать:
мы знаем, что соли и кислоты состоят из катионов и анионов, Катион может быть или металл или водород, анион - это либо гидроксогруппа - OH или кислотный остаток - SO4(2-) и прочее.
Вернемся к уравнению
Na2SO4 + BaCl2 = 2NaCl + BaSO4, разложим на ионы
Смотрим в исходные вещества. Na2SO4 - сульфат натрия, соль растворимая, состоит из катиона натрия и сульфат - аниона (катион - положительно заряжен, анион отрицательно)
разбиваем эту соль на составные части : 2Na(+) и SO4(2-), знаки ставятся в правом верхнем углу над символом элемента. Двойку перед натрием мы взяли из соединения - у нас ведь натрий ДВА эс о четыре.
Смотрим следующее вещество - хлорид бария BaCl2 - соль растворимая, смело бьем ее на ионы - Ba(2+) и 2Cl(-) - здесь надеюсь ясно откуда мы взяли двойку
Пишем что у нас получилось в левой части:
2Na(+) + SO4(2-) + Ba(2+) + 2Cl(-)
Смотрим в правую часть. там имеем сульфат бария - нерастворимую соль и гидроксид натрия - растворимое основание. Сульфат бария мы не можем разбить на ионы, ведь она(соль) не растворимая, бьем на ионы только основание:
2Na(+) + 2OH(-)
Переписываем в одну строчку:
BaSO4 + 2Na(+) + 2OH(-)
Теперь соединяем правую и левую часть уравнений состоящих из ионов:
2Na(+) + SO4(2-) + Ba(2+) + 2Cl(-) = BaSO4 + 2Na(+) + 2OH(-)
Смотрим, какие ионы одинаковые и в правой и в левой части и зачеркиваем их, зачеркнув их получим:
SO4(2-) + Ba(2+) = BaSO4
1) Оксиды.
Железу свойственны два ряда соединений: железо (II) и железо (III)
FeO и Fe₂O₃
Оксид железа (II) - основный, оксид железа (III) - слабо-амфотерный.
С), как основный оксид, проявляет соответствующие химические свойства, вступая в реакции с водой, кислотами и кислотными оксидами. Может проявлять окислительные свойства.
Оксид железа (III), как амфотерный, вступает в реакции с щелочами и кислотами и кислотными оксидами, может вытеснять более летучие оксиды из солей, может частично восстанавливаться водородом, угарным газом и др.
Оксиды железа применяют, например, в пищевой промышленности для создания пищевых красителей или в процессе выплавки чугуна.
2) Гидроксиды.
Гидроксид железа (II) и гидроксид железа (III) - соответственно основный и амфотерный гидроксид.
Гидроксид железа (II) - белый осадок, поэтому вступает в реакции только с кислотами, а при нагревании разлагается на соответствующий оксид и воду. На воздухе постепенно окисляется, превращаясь в Fe(OH)₃.
Применяется в изготовлении аккумуляторов.
Гидроксид железа (III) - также является осадком, разлагающимся при нагревании, реагирующим с кислотами и с щелочами.
Применяется для отчистки газов от сероводорода, как противоядие от мышьяка.
3) Соли.
Железо образует соли, реагируя с некоторыми неметаллами и с кислотами. При реакции с йодом, серой, бромоводородом, соляной и разбавленной серой кислотой получается соль, в которой железо имеет степень окисления +2. Пр реакции с хлором, бромом, концентрированной серной и с разбавленной и концентрированной азотными (причем с концентрированными азотной и серной кислотой железо при обычных условиях не реагирует, реакция идет при нагревании) кислотами получаются соли, в которых железо имеет степень окисления +3.
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Fe₂(SO₄)₃ , сульфат железа (III), применяют при очистке воды, в качестве растворителя и в других целях.
FeCl₃ , хлорид железа (III), используют при очистке воды, в качестве протравы при крашении тканей.
Массовая доля HCl в растворе:
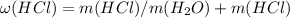
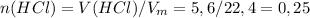 моль
моль
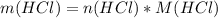 = 0,25 * 36,5 = 9,125 г.
= 0,25 * 36,5 = 9,125 г.
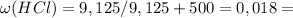 1,8%
1,8%
ответ: 1,8%