Задание 1.
Оксиды:
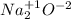 - оксид натрия (основной)
- оксид натрия (основной)
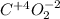 - оксид углерода(IV), углекислый газ, (кислотный)
- оксид углерода(IV), углекислый газ, (кислотный)
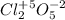 - оксид хлора(V) (кислотный)
- оксид хлора(V) (кислотный)
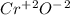 - оксид хрома (II) (основный)
- оксид хрома (II) (основный)
Кислоты:
H2SiO3 - кремниевая кислота
H2MnO4 - марганцовистая кислота
Основания:
Ca(OH)2 - гидроксид кальция
Al(OH)3 - гидроксид алюминия
Соли:
Na2SO4 - сульфат натрия
Mg(NO3)2 - нитрат магния
Задание 2.
Оксид магния - MgO
2Mg + O2 = 2MgO
Хлорид серы(IV) SCl4
S + 2 Cl2 = SCl4
Фосфид калия - K3P
3K + P = K3P
Оксид серы(VI) SO2
S + O2 = SO2
Нитрид магния - Mg3N2
3Mg + N2 = Mg3N2
(остальное постараюсь чуть позже дописать, но на такой объем маловато, чесслово)
Задание 3. Составьте уравнения реакций образования следующих гидроксидов из соответствующих им оксидов:
Гидроксид кальция,
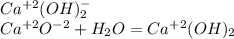
гидроксида натрия,
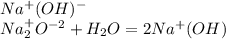
сернистая кислота
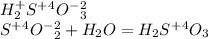
Задание 4. Расставьте коэффициенты в уравнениях реакций. Укажите тип реакции
-----------------------------------------------------------
Cr(+6)O3(тв) → Cr(+3)2O3 + O2
Cr(+6) + 3e(-) = Cr(+3) |12(общ дел.)| *4|
2O(2-) - 4e(-) = O2(0) |12(общ дел.)| *3|
С учетом индексов:
4CrO3 --> 2Cr2O3 + 3O2 -- ОВР (окислительно-восстановительная реакция, реакция разложения)
-----------------------------------------------------------
K2S + CuCl2→ Cu S↓ + 2KCl - реакция ионного обмена в растворе (с образованием нерастворимого соединения)
-----------------------------------------------------------
2NO + O2 ↔ 2NO2 - реакция соединения, обратимая
-----------------------------------------------------------
WO3+ 3H2→ W+ 3H2O
Реакция восстановления ванадия, ОВР(окислительно-восстановителььная)
-----------------------------------------------------------
2KClO3(тв) → 2KCl(тв) + 3O2
Реакция разложения хлората калия (бертолетовой соли), ОВР
Задание 5. Напишите уравнения реакций взаимодействия алюминия
с хлором
2Al + 3Cl2 = 2AlCl3
c разбавленной серной кислотой,
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
оксидом хрома (III),
Al + Cr2O3 = Cr + Al2O3
раствором сульфата меди(II)
2Al +3CuSO4 = Al2(SO4)3 + 3Cu
Сu(OH)2+ 2HCI = CuCl2 +2H2O
Сu(2+) +2OH(-) + 2H(+) +2Cl(-)= Сu(2+) +2Cl(-) + 2H2O
Сu(OH)2+ 2HNO3 = Cu(NO3)2 +2H2O
Сu(2+) +2OH(-) + 2H(+) +2NO3(-)= Сu(2+) +2NO3(-)+ 2H2O
Это обе реакции нейтрализации, в результате которых получается малодиссоциирующее вещество- вода
3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O+ 3CO2
6K(+) + CO3(2-) +6H(+) +2PO4(3-) = 6K(+) +2PO4(3-) + 3H2O+ 3CO2
С азотной и соляной кислотой так же продуктом является неустойчивое соединение - угольная кислота, которая распадается на воду и углекислый газ.
NaCl + AgNO3 → AgCl↓ + NaNO3
Na+1 +Cl-1 + Ag+1 + NO3-1 → AgCl↓ + Na+1 + NO3-1
Ag+1 + Cl-1 → AgCl↓
2HNO3 + (NH4)2CO3 → 2NH4NO3 + CO2↑ + H2O
2H+1 + 2NO3-1 + 2NH4+1 + CO3+2 → 2NH4+1 + 2NO3-1 +CO2↑ +H2
2H+1 + CO3+2 → CO2↑ + H2O
2KOH + (NH4)2CO3 → K2CO3 + 2NH3↑ + 2H2O
2K+1 + 2OH-1 + 2NH4+1 + CO3+2 → 2K+1 + CO3-2 + 2NH3↑ + 2H2O
2OH-1 + 2NH4+1 → 2NH3↑ + 2H2O
OH-1 + NH4+1 → NH3↑ + H2O
ZnSO4 + (NH4)2CO3 → ZnCO3↓ + (NH4)2SO4
Zn+2 + SO4-2 + 2NH4+1 + CO3+2 → ZnCO3↓ + 2NH4+1 + SO4-2
Zn+2 + CO3+2 → ZnCO3↓
HNO3 + KOH → KNO3 + H2O
H+1 + NO3-1 + K+1 + OH-1 → K+1 + NO3-1 + H2O
H+1 + OH-1 → H2O
Ca(OH)2-основание нерастворимое
CO2-оксид основной
H2SiO3-кислота основная
Na2SO4-соль средняя
Al(OH)3-основание нерастворимое
Mg (NO3)2-кислота кислородосодержащая
H2MnO4-оксид кислотный
Cl2O5-оксид кислотный
CrO-оксид основной