скорость прямой реакции увеличилась в 8 раз;
скорость обратной реакции увеличилась в 4 раза.
Обозначим концентрации реагирующих веществ: [NO] = а, [O2] = b, [NO2] = c. Согласно закону действия масс, скорости и прямой и обратной реакций до изменения объема:
скорость прямой реакции формула
скорость обратной реакции формулаПосле уменьшения объема гомогенной системы в 2 раза концентрация каждого из реагирующих веществ увеличится в 2 раза: [NO] = 2а, [O2] =2 b, [NO2] = 2c. Скорость реакции объем. При новых концентрациях скорости (υ’пр.) прямой и (υ’обр.) обратной реакций равны:
скорость прямой реакции после изменения объема
скорость обратной реакции после изменения объема
Отсюда, скорость реакции объем:
скорость реакции объем
Следовательно, скорость прямой реакции увеличилась в 8 раз, а обратной – только в 4 раза. Равновесие системы сместилось в сторону образования NO2.
№1 Напишите молекулярное полное и сокращенное ионное уравнение реакций между растворами следующих веществ: хлорида бария и серной кислотой
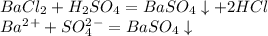
-----------------------------------
Расставьте коэффициеты на основании метода электронного баланса. Укажите окислитель и восстановитель
а) Na - восстановитель, O2 - окислитель
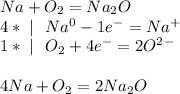
б) S(2-) - восстановитель; N(5+) - окислитель
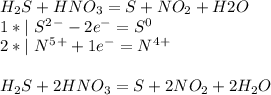
-----------------
Могут ли одновременно находиться в растворе следующие пары веществ:
а) HNO3 и NA2CO3
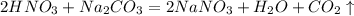
- нет; идет реакция с выделением CO2
б) FECI3 и BA(OH)2
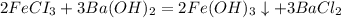
в) KBr и NaI - да, могут. Осадка, выделения газа - не будет.
Количество кислорода, выделяемого в течение определенного периода времени, одинаково для всех катализаторов
Объяснение: